
Wetenschap
Wat is de reactie tussen natriumhydroxide en vocht in lucht?
Hier is de chemische vergelijking voor de reactie:
NaOH (S) + H₂o (L) → Na⁺ (aq) + oh⁻ (aq) + warmte
Verklaring:
* NaOH (s): Vast natriumhydroxide.
* h₂o (l): Vloeibaar water (vocht).
* na⁺ (aq): Natriumionen opgelost in water.
* oh⁻ (aq): Hydroxide -ionen opgelost in water.
Het reactieproces:
1. Wanneer natriumhydroxide in contact komt met vocht, absorbeert het de watermoleculen.
2. De watermoleculen breken de ionische bindingen uit het NaOH -kristalrooster uit elkaar.
3. Natrium (Na⁺) en hydroxide (OH⁻) ionen worden vrijgegeven en worden omgeven door watermoleculen (hydratatie).
4. De oplossing wordt basic (alkalisch) vanwege de aanwezigheid van hydroxide -ionen.
gevolgen:
* delliquescence: Natriumhydroxide is deliquescent, wat betekent dat het voldoende vocht uit de lucht absorbeert om volledig op te lossen, waardoor een vloeibare oplossing wordt gevormd. Dit kan snel gebeuren in vochtige omgevingen.
* Warmte -generatie: De reactie geeft warmte vrij, wat aanzienlijk kan zijn als er grote hoeveelheden natriumhydroxide bij betrokken zijn.
* Corrosie: De gevormde oplossing kan zeer corrosief zijn voor materialen zoals metalen en andere oppervlakken.
Veiligheidsoverwegingen:
* hantering: Natriumhydroxide moet met zorg worden behandeld, met behulp van geschikte persoonlijke beschermingsapparatuur zoals handschoenen, bril en laboratoriumjassen.
* opslag: Het moet worden opgeslagen in luchtdichte containers om blootstelling aan vocht te voorkomen.
* Verwijdering: Gooi de natriumhydroxide -oplossing correct weg volgens de lokale voorschriften.
 Welke wetenschapper zei dat er verschillende elementen zijn gemaakt van soorten atomen?
Welke wetenschapper zei dat er verschillende elementen zijn gemaakt van soorten atomen?  Zeemosselen zijn een model voor het verbeteren van kracht, rekbaarheid en hechting in hydrogels voor wondgenezing
Zeemosselen zijn een model voor het verbeteren van kracht, rekbaarheid en hechting in hydrogels voor wondgenezing Wat zijn 7 takken van chemie?
Wat zijn 7 takken van chemie?  Wat is een covalente band?
Wat is een covalente band?  Hoe kan een chemische vergelijking van natriumfosfaat die reageert met calciumnitraat om te produceren en gebalanceerd te worden?
Hoe kan een chemische vergelijking van natriumfosfaat die reageert met calciumnitraat om te produceren en gebalanceerd te worden?
Hoofdlijnen
- Wat kan de limieten van een organismen van tolerantie beïnvloeden?
- Hoe heten de cellen in neus en keel die stofdeeltjes opvangen?
- Wat is de werkelijke grootte van mitochondriën?
- Waarom worden groene algen geclassificeerd als planten en geen protist?
- Welk dubbele membraanorganel beschermt DNA?
- Wat zijn enkele dingen in de natuur het alfabet?
- Hoe muizenembryo's links van rechts bepalen
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Hebben microben het leven geholpen bij het koloniseren van land?
- Chemicus synthetiseert nieuwe verbindingen met sterke antidiabetische eigenschappen
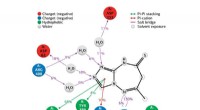
- Monolithische nanokoolstofkatalysatoren starten selectieve oxidatie van diwaterstofsulfide

- MXene-materialen helpen fotodetectoren het licht te zien

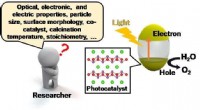
- De reis naar schone energie versnellen door optimalisatie van fotokatalysatoren
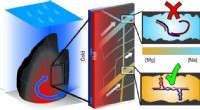
- De juiste mix van zouten om het leven op gang te krijgen
 Onderzoek onderzoekt de omgeving van bolvormige sterrenhoop NGC 6355
Onderzoek onderzoekt de omgeving van bolvormige sterrenhoop NGC 6355  Natuurkundigen veranderen een kristal in een elektrisch circuit
Natuurkundigen veranderen een kristal in een elektrisch circuit Hoe veranderden wetenschappelijke ontdekkingen in de jaren 1920 van mening van de wereld?
Hoe veranderden wetenschappelijke ontdekkingen in de jaren 1920 van mening van de wereld?  Hoe lang duren orchideeënbloeien? Tips voor het kweken van orchideeën
Hoe lang duren orchideeënbloeien? Tips voor het kweken van orchideeën  Wat is plasmide en welk voordeel kan een bacterie krijgen door er een te verwerven?
Wat is plasmide en welk voordeel kan een bacterie krijgen door er een te verwerven?  Bedrijven die de pandemie hebben overleefd, zullen herstellen
Bedrijven die de pandemie hebben overleefd, zullen herstellen Waarom studeren we astronomie?
Waarom studeren we astronomie?  Zal de zon voor altijd schijnen waarom of niet?
Zal de zon voor altijd schijnen waarom of niet?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

