
Wetenschap
Bereken delta G bij 298K voor de reactie van stikstof en waterstof om ammoniak te vormen gelijk is aan -33,3kjn -mengsel bestaat uit FollWing N2.5 ATM's H2,75 NH3 2.0?
1. De evenwichtige chemische vergelijking:
De evenwichtige chemische vergelijking voor de reactie is:
N₂ (g) + 3H₂ (g) ⇌ 2NH₃ (g)
2. Standaard Gibbs vrije energieverandering (ΔG °)
U hebt de standaard Gibbs -vrije energieverandering (ΔG °) nodig voor deze reactie. U kunt deze waarde vinden in een tabel met thermodynamische gegevens. Voor de vorming van ammoniak is ΔG ° typisch rond -33,3 kJ/mol bij 298K.
3. Het reactiequotiënt (Q)
Het reactiequotiënt (Q) is een maat voor de relatieve hoeveelheden reactanten en producten op elk willekeurig moment. Het wordt berekend met behulp van de gedeeltelijke druk van de gassen:
Q =(p (nH₃) ²) / (p (n₂) * p (h₂) ³)
Sluit de gegeven gedeeltelijke druk aan:
Q =(2.0²) / (2.5 * 2.75³)
4. De Gibbs Free Energy Change (ΔG)
De relatie tussen ΔG, ΔG ° en q wordt gegeven door:
ΔG =ΔG ° + rtln (q)
Waar:
* R =ideale gasconstante (8.314 J/mol · k)
* T =temperatuur in Kelvin (298K)
Vervang nu de waarden:
ΔG =-33,3 kJ/mol + (8.314 j/mol · k * 298 k * ln (q))
belangrijke opmerkingen:
* Converteer kj/mol naar j/mol voor consistentie in eenheden.
* Zorg ervoor dat u de juiste waarde voor ΔG ° uit een betrouwbare bron gebruikt.
* De waarde van ΔG zal negatief zijn als de reactie de productvorming bevordert onder de gegeven omstandigheden.
Berekening:
1. Bereken Q:Q =(2.0²) / (2.5 * 2.75³) ≈ 0,16
2. Converteer Δg ° naar j/mol:Δg ° =-33,3 kJ/mol * 1000 j/kj =-33300 j/mol
3. Bereken ΔG:
ΔG =-33300 j/mol + (8.314 J/mol · k * 298 k * ln (0,16)) ≈ -38422 j/mol
Daarom is de Gibbs vrije energieverandering (AG) voor de reactie van stikstof en waterstof om ammoniak te vormen bij 298K, gezien de gegeven gedeeltelijke druk, ongeveer -38,4 kJ/mol.
Deze negatieve waarde geeft aan dat de reactie spontaan is (de productvorming van de productmunnen) onder deze omstandigheden.
 Wat is de milieuvriendelijke onvriendelijke component van gechloreerde fluorocoolwaterstoffen die uiteindelijk ozon beschadigen?
Wat is de milieuvriendelijke onvriendelijke component van gechloreerde fluorocoolwaterstoffen die uiteindelijk ozon beschadigen?  Chemici leren computerprogramma's om krachten tussen atomen nauwkeurig te modelleren
Chemici leren computerprogramma's om krachten tussen atomen nauwkeurig te modelleren Is CH4 covalent of een ionische binding?
Is CH4 covalent of een ionische binding?  Het proces waarbij watermoleculen ionen omringen tijdens het oplossen wordt opgeroepen?
Het proces waarbij watermoleculen ionen omringen tijdens het oplossen wordt opgeroepen?  Onderzoekers ontwikkelen baanbrekende röntgentechniek om oude artefacten te analyseren
Onderzoekers ontwikkelen baanbrekende röntgentechniek om oude artefacten te analyseren
 Onthullende binnentemperatuur van Antarctische ijskap
Onthullende binnentemperatuur van Antarctische ijskap De overvloed aan uranium en thorium schatten met geoneutrino's
De overvloed aan uranium en thorium schatten met geoneutrino's Een intense blik op La Brea Tar Pits verklaart waarom we coyotes hebben en geen sabeltandkatten
Een intense blik op La Brea Tar Pits verklaart waarom we coyotes hebben en geen sabeltandkatten  Geef de beren geen eten! Hoe parken ervoor zorgen dat bezoekers de natuur beschermen
Geef de beren geen eten! Hoe parken ervoor zorgen dat bezoekers de natuur beschermen  Voorspelbaarheidslimiet:wetenschappers vinden grenzen aan weersvoorspelling
Voorspelbaarheidslimiet:wetenschappers vinden grenzen aan weersvoorspelling
Hoofdlijnen
- Wetenschappers identificeren sleutelfactoren die microben helpen gedijen in ruwe omgevingen
- Waarom leven vogels doorgaans langer dan zoogdieren?
- Hoe is een Paramecium Digest Food?
- Zijn dieren kwetsbaar voor COVID-19?
- Zeegrasweiden breiden zich snel uit nabij bewoonde eilanden op de Malediven
- Jesse keek naar een cel via microscoop en zag mitochondria membranen wat zou kunnen zeggen over de cel?
- Wat beschermt de cel en reguleert?
- Wat is een witte neushoorn herbivoor omnivore of carnivoor?
- Kan de wetenschap al onze vraag beantwoorden, heeft uw antwoord uitgelegd?
- Kunstmatige intelligentie kan wetenschappers helpen bij het maken van spray-on zonnecellen

- De snelle test van NIST kan de behandeling met antibiotica versnellen en resistentie tegen geneesmiddelen bestrijden

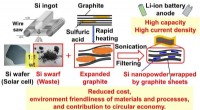
- Van afval tot schat:Siliciumafval vindt een nieuwe toepassing in Li-ionbatterijen
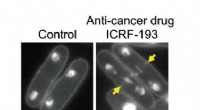
- Antikankermechanisme onthuld in gistexperimenten
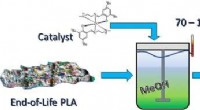
- Chemische recycling maakt nuttig product van bioplastic afval
 Top 5 dingen die u kunt doen om groener te rekenen
Top 5 dingen die u kunt doen om groener te rekenen  Wat zijn de wetenschappelijke principes achter gitaar?
Wat zijn de wetenschappelijke principes achter gitaar?  NASA-functionaris:Gespannen momenten maar kalme bemanning bij afgebroken lancering
NASA-functionaris:Gespannen momenten maar kalme bemanning bij afgebroken lancering Pop-up fietspaden en grassroots speeltuinen:hoe COVID-19 steden zal veranderen
Pop-up fietspaden en grassroots speeltuinen:hoe COVID-19 steden zal veranderen Waarom werkt Pepsin het beste op 37 graden C?
Waarom werkt Pepsin het beste op 37 graden C?  Singapore keurt nepnieuwswet goed ondanks felle kritiek
Singapore keurt nepnieuwswet goed ondanks felle kritiek Europese oogstverliezen door hitte en droogte verdrievoudigd in 50 jaar:studie
Europese oogstverliezen door hitte en droogte verdrievoudigd in 50 jaar:studie Hoe kan zinkchloride van siliciumoxide worden gescheiden?
Hoe kan zinkchloride van siliciumoxide worden gescheiden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

