
Wetenschap
Welk element zou iconisch binden aan chloor?
Hier zijn enkele voorbeelden van metalen die iconisch zouden binden aan chloor:
* natrium (NA): Natrium is in groep 1, wat betekent dat het één valentie -elektron heeft dat het gemakkelijk verliest om een +1 ion (Na +) te vormen. Dit vormt natriumchloride (NaCl) , algemeen bekend als tafelzout.
* kalium (k): Net als natrium is kalium ook in groep 1 en vormt een +1 ion (k +). Dit vormt kaliumchloride (KCL) , gebruikt in kunstmest en medicijnen.
* magnesium (mg): Magnesium is in groep 2 en verliest gemakkelijk twee elektronen om een +2 ion te vormen (mg2 +). Dit vormt magnesiumchloride (mgcl2) , gebruikt in de-ibing agenten en als droogmiddel.
* calcium (CA): Net als magnesium is calcium in groep 2 en vormt een +2 ion (Ca2 +). Dit vormt calciumchloride (CACL2) , gebruikt als droogmiddel en in wegzout.
In het algemeen hebben metalen van groepen 1 en 2, evenals sommige overgangsmetalen, de neiging om ionische bindingen met chloor te vormen.
Hoofdlijnen
- Wat is het doel van het Human Genome Project?
- Chemici, biologen, archeologen:wie zal de recepten van onze voorouders opgraven?
- Nieuwe studie wijst op onverwachte voordelen van rabiësvaccinatie bij honden
- Wat is het belang van nucleïnezuren?
- Waarom is DNA-replicatie belangrijk voor de celdeling?
- Doorbraak laat zien hoe DNA wordt 'bewerkt' om genetische ziekten te corrigeren
- Samengestelde ogen een continu kenmerk van evolutie
- Wat is bacteriën op de een of andere manier verantwoordelijk voor alle op één behalve een van de processenomgeving?
- Hoe superbacteriën spiegelbeelden gebruiken om antibioticaresistentie te creëren
- Selectieve fotothermische therapie met supramoleculaire radicale anionen die in situ worden gegenereerd
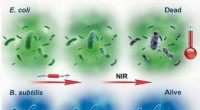
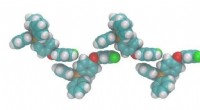
- Dankzij subtiele ioninteracties op moleculair niveau kunnen wetenschappers het smeltpunt van ionische verbindingen afstemmen
- Wetenschappers vinden nieuwe manier om te testen op resistente infecties
- Eiwitten vormgeven om chaperonne-gerelateerde ziekten te begrijpen
- Zijdevezels kunnen hightech natuurlijke metamaterialen zijn

 In astronomie zijn er blauwe reuzen, hebben ze namen of gewoon rood genoemd enz.?
In astronomie zijn er blauwe reuzen, hebben ze namen of gewoon rood genoemd enz.?  De Andromeda Galaxy Show is een blauwe verschuiving in zijn spectra Wat vertelt dit ons over beweging ten opzichte van de aarde en de rest van het soloar -systeem?
De Andromeda Galaxy Show is een blauwe verschuiving in zijn spectra Wat vertelt dit ons over beweging ten opzichte van de aarde en de rest van het soloar -systeem?  Wat zijn de geleiders en isolatoren in een eenvoudig circuit?
Wat zijn de geleiders en isolatoren in een eenvoudig circuit?  COVID-19 vaccinatiestrategieën:wanneer is één dosis beter dan twee?
COVID-19 vaccinatiestrategieën:wanneer is één dosis beter dan twee? Welke 2 soorten sterren kunnen vormen uit een nevel?
Welke 2 soorten sterren kunnen vormen uit een nevel?  Welk volume waterstof in L wordt geproduceerd uit de volledige reactie van 3143 molkenzuur 3143 mol bij STP mg S 2HCl aq mgcl2 H2 g?
Welk volume waterstof in L wordt geproduceerd uit de volledige reactie van 3143 molkenzuur 3143 mol bij STP mg S 2HCl aq mgcl2 H2 g?  Wat is chloroformwater met dubbele sterkte?
Wat is chloroformwater met dubbele sterkte?  In welke fase van meiose 2 verdeelt het cytoplasma?
In welke fase van meiose 2 verdeelt het cytoplasma?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


