
Wetenschap
Wat is het verschil tussen ammoniumbisulfiet bisulfide en bisulfaat?
1. Ammonium bisulfiet (NH₄HSO₃)
* ammonium bisulfiet is een zout gevormd door het reageren van ammoniak (NH₃) met zwavelzuur (h₂so₃).
* Het wordt vaak gebruikt als conserveermiddel en antioxidant in voedsel en dranken.
* Het "bisulfiet" -gedeelte geeft de aanwezigheid van het HSE₃⁻ -ion aan, dat het bisulfietion is.
2. Bisulfide (hs⁻)
* bisulfide is het anion gevormd wanneer waterstofsulfide (H₂s) één proton verliest (H⁺).
* Het is een gemeenschappelijk onderdeel van oplossingen die worden gebruikt in analytische chemie, evenals bij de behandeling van bepaalde industriële afvalstromen.
* Merk op dat "bisulfide" vaak door elkaar wordt gebruikt met "hydrosulfide", wat hetzelfde ion is.
3. Bisulfate (hso₄⁻)
* bisulfate is het anion gevormd wanneer zwavelzuur (h₂so₄) één proton verliest (H⁺).
* Het wordt vaak aangetroffen in oplossingen die worden gebruikt voor het reinigen en in zure omgevingen.
* Het "bisulfaat" -gedeelte geeft de aanwezigheid van het HSE₄⁻ -ion aan, wat het bisulfaat -ion is.
Belangrijkste verschillen:
* anionen: Het belangrijkste verschil ligt in de aanwezige anionen:bisulfiet (hso₃⁻), bisulfide (hs⁻) en bisulfaat (hso₄⁻).
* zwaveloxidatietoestand: Het zwavelatoom heeft verschillende oxidatietoestanden in elke verbinding:+4 in bisulfiet, -2 in bisulfide en +6 in bisulfaat.
* zuurgraad: Bisulfate (HSO₄⁻) is een sterker zuur dan bisulfiet (HSO₃⁻).
* Toepassingen: De specifieke toepassingen van elke verbinding variëren op basis van hun chemische eigenschappen.
Belangrijke opmerking:
Het is cruciaal om de juiste terminologie te gebruiken omdat de verschillen in deze verbindingen belangrijke implicaties kunnen hebben voor hun chemische gedrag en toepassingen.
 Hoeveel mol zuurstof is er nodig voor de volledige verbranding van heptaan?
Hoeveel mol zuurstof is er nodig voor de volledige verbranding van heptaan?  Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren
Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren  Gras vervangt plastic in meeneemverpakkingen
Gras vervangt plastic in meeneemverpakkingen Waar wordt een evenwicht voor gebruikt in de chemie?
Waar wordt een evenwicht voor gebruikt in de chemie?  Het zoetwaterverbruik van elektriciteitscentrales verminderen met nieuw silicafilter
Het zoetwaterverbruik van elektriciteitscentrales verminderen met nieuw silicafilter
 Milieuvriendelijke waterbehandeling werkt het beste met ervaren bacteriële flora
Milieuvriendelijke waterbehandeling werkt het beste met ervaren bacteriële flora NASA vindt Jangmi nu een extra-tropische storm
NASA vindt Jangmi nu een extra-tropische storm Onderzoek toont aan dat bosbehoud een krachtig hulpmiddel is om de voeding in ontwikkelingslanden te verbeteren
Onderzoek toont aan dat bosbehoud een krachtig hulpmiddel is om de voeding in ontwikkelingslanden te verbeteren NASA ziet tropische cycloon koken sterk getroffen door windschering
NASA ziet tropische cycloon koken sterk getroffen door windschering Verschillen tussen ecocentrisch en biocentrisch
Verschillen tussen ecocentrisch en biocentrisch
Hoofdlijnen
- Fossiele vondst onthult hoe groot de vleesetende dinosaurus kan zijn geworden
- Wat is om te beginnen met een zaadje?
- Overlast of voedingsstof? Kudzu is veelbelovend als voedingssupplement
- Ik kweek bacteriën en dit witte, pluizige spul erbovenop. Is dat ook of is het iets anders?
- Waarom worden genetisch gemodificeerde gewassen gemaakt?
- Bijen zijn verbazingwekkend goed in het nemen van beslissingen – en ons computermodel legt uit hoe dat mogelijk is
- Welke pigmenten gebruiken planten om fotosynthese uit te voeren en wat deze specifiek voor het proces?
- Hoe omvat landbouw wetenschap?
- Wat gebeurt er met chromosomen tijdens anafase?
- Goud-fosfor-nanobladen katalyseren selectief aardgas tot groenere energie
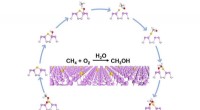
- Van broeikasgassen tot plastic:nieuwe katalysator voor recycling koolstofdioxide ontdekt

- Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten
- Nieuwe topologische materialen kunnen meerdere elektrische eigenschappen hebben

- Geïnspireerd door slakken, onderzoekers bedenken een omkeerbare lijm die sterk genoeg is om een persoon vast te houden

 Waarom COVID-19 steden niet zal doden
Waarom COVID-19 steden niet zal doden Nieuwe horizonten voor het aansluiten van toekomstige kwantumcomputers op een kwantumnetwerk
Nieuwe horizonten voor het aansluiten van toekomstige kwantumcomputers op een kwantumnetwerk Een barometer bevestigen
Een barometer bevestigen Het vriespunt van een stof is?
Het vriespunt van een stof is?  Heeft een nutron een positieve of negatieve lading?
Heeft een nutron een positieve of negatieve lading?  Hoeveel gram koper kan worden verwarmd van 20 oc tot 75 als 1200 calorieën worden toegepast?
Hoeveel gram koper kan worden verwarmd van 20 oc tot 75 als 1200 calorieën worden toegepast?  Vier soorten orbitalen en hun vormen
Vier soorten orbitalen en hun vormen Zuurstof maken met magneten kan astronauten helpen gemakkelijker te ademen
Zuurstof maken met magneten kan astronauten helpen gemakkelijker te ademen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

