
Wetenschap
Wat is de bron van atomaire emissiespectra?
1. excitatie: Atomen bevinden zich meestal in hun grondtoestand, waarbij elektronen hun laagste energieniveaus bezetten. Wanneer energie wordt toegevoegd aan een atoom (bijvoorbeeld warmte, elektriciteit of licht), absorberen elektronen deze energie en springen ze naar hogere energieniveaus. Dit wordt excitatie genoemd .
2. Ontspanning: Geweerde elektronen zijn onstabiel en hebben de neiging terug te keren naar hun lagere energieniveaus. Deze overgang geeft de geabsorbeerde energie vrij in de vorm van licht.
3. emissie: Het uitgezonden licht heeft een specifieke energie, overeenkomend met het verschil in energie tussen de opgewonden en grondstaten. Deze energie wordt gekwantiseerd, wat betekent dat het alleen in afzonderlijke waarden kan bestaan. Elk specifiek verschil op energieniveau komt overeen met een unieke golflengte (en dus kleur) van licht.
4. Spectrale lijnen: Het uitgezonden licht wordt gescheiden in zijn componentgolflengten met behulp van een apparaat zoals een spectroscoop. Het resultaat is een reeks heldere lijnen, genaamd emissielijnen , op een donkere achtergrond. Deze lijnen vertegenwoordigen de specifieke golflengten van licht die door de geëxciteerde atomen worden uitgezonden.
Sleutelpunten:
* uniek spectrum: Elk element heeft een uniek atoomemissiespectrum, zoals een vingerafdruk. Hierdoor kunnen we elementen in een monster identificeren.
* Toepassingen: Atomische emissiespectroscopie wordt op verschillende gebieden gebruikt, waaronder:
* Analytische chemie:het identificeren en kwantificeren van elementen in monsters.
* Astronomie:het bestuderen van de samenstelling van sterren en planeten.
* Forensics:analyse van sporenbevestiging.
Samenvattend ontstaan atomaire emissiespectra uit de energie die wordt vrijgegeven wanneer geëxciteerde elektronen in atomen terugkeren naar hun grondstaten, waardoor licht uitzendt met specifieke golflengten die uniek zijn voor elk element.
 Ongehaaste orkanen:studie zegt dat tropische cyclonen vertragen
Ongehaaste orkanen:studie zegt dat tropische cyclonen vertragen Wat is het verschil tussen vindbaar en zichtbaar?
Wat is het verschil tussen vindbaar en zichtbaar?  Hoe zet je de wetenschappelijke theorie in een zin?
Hoe zet je de wetenschappelijke theorie in een zin?  Het verkennen van de synergie van westenwinden en de moesson op de Mount Everest, evenals hun klimaat- en milieueffecten
Het verkennen van de synergie van westenwinden en de moesson op de Mount Everest, evenals hun klimaat- en milieueffecten Diverse tropische bossen groeien snel ondanks wijdverbreide fosforbeperking
Diverse tropische bossen groeien snel ondanks wijdverbreide fosforbeperking
Hoofdlijnen
- Wat is één organel die alle prokaryotische en eukaryotische cellen hebben?
- Hoe wordt plasmide -DNA vergelijkbaar met de gevonden in chromosomen?
- Hoe diabetes werkt
- Kip van de zee? De tonijnteelt krijgt een impuls
- Plantenorgaan Welke fotosynthese vindt plaats?
- Flashmob in de kern:studie maakt duidelijk waarom sommige eiwitten 'samenkomen'
- Voorkomt promiscuïteit uitsterven?
- Hoe beïnvloedt fosforylering de eiwitactiviteit?
- Hoe muizen de beste vluchtroute kiezen
- Synthese van een zeldzaam metaalcomplex van lachgas opent nieuwe perspectieven voor
- Kijken naar atomen die bewegen in hybride perovskietkristallen onthult aanwijzingen voor het verbeteren van zonnecellen

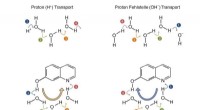
- Vooruit of achteruit? Nieuwe routes voor protonen in water of methanol
- Neutronen gebruiken om te bestuderen hoe resistente bacteriën evolueren

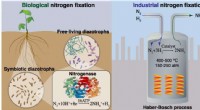
- Groenere benaderingen van stikstofbinding verkennen
 Wat is de relatie tussen de hoeveelheid licht en de grootte een stekende brandnetelblad?
Wat is de relatie tussen de hoeveelheid licht en de grootte een stekende brandnetelblad?  Een algoritme voor kunstmatige intelligentie kan de wetten van de kwantummechanica leren
Een algoritme voor kunstmatige intelligentie kan de wetten van de kwantummechanica leren Cave raiders:Thaise archeologen jagen op oude kunstwerken
Cave raiders:Thaise archeologen jagen op oude kunstwerken Wat is de aarde -baansnelheid?
Wat is de aarde -baansnelheid?  Buchli, Kavandi geselecteerd voor US Astronaut Hall of Fame
Buchli, Kavandi geselecteerd voor US Astronaut Hall of Fame Hoeveel milliliter zijn er in 9 centimeter?
Hoeveel milliliter zijn er in 9 centimeter?  Onderzoekers wenden zich tot stenen om de oude oorsprong van Bitcoin te vinden
Onderzoekers wenden zich tot stenen om de oude oorsprong van Bitcoin te vinden Transat-aandeelhouders accepteren overname Air Canada
Transat-aandeelhouders accepteren overname Air Canada
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

