
Wetenschap
Wat is binding door elektronenoverdracht?
Hier is het basisidee:
* metalen hebben de neiging elektronen te verliezen (positief geladen kationen worden).
* niet -metalen hebben de neiging elektronen te winnen (negatief geladen anionen worden).
Wanneer een metaal en een niet -metaal samenkomen, brengt het metaalatoom een of meer elektronen over naar het niet -metalen atoom. Dit creëert een elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen, die een ionische binding vormen .
Voorbeeld:
Overweeg de vorming van natriumchloride (NaCl):
* natrium (na) , een metaal, verliest één elektron om een positief geladen natriumion (Na⁺) te worden.
* chloor (Cl) , een niet -metaal, krijgt één elektron om een negatief geladen chloride -ion te worden (CL⁻).
Deze tegengesteld geladen ionen worden tot elkaar aangetrokken en vormen een ionische binding.
Sleutelpunten:
* Het elektronenoverdrachtsproces is vereenvoudigd. In werkelijkheid worden de elektronen niet volledig overgedragen, maar eerder ongelijk gedeeld.
* De resulterende ionen worden bij elkaar gehouden door elektrostatische krachten.
* Ionische bindingen zijn meestal sterk en resulteren in de vorming van vaste verbindingen met hoge smeltpunten.
Opmerking: Hoewel het concept van elektronenoverdracht nuttig is voor het begrijpen van ionische binding, is het belangrijk om te onthouden dat de ware aard van binding complexer is en gedeelde elektronen omvat (covalente binding).
 Een nieuwe methode om spiegels van variabele grootte af te drukken met een reflectie van meer dan 99%
Een nieuwe methode om spiegels van variabele grootte af te drukken met een reflectie van meer dan 99% Waarom is het smeltpunt van diamant hoger dan dat siliciumcarbide?
Waarom is het smeltpunt van diamant hoger dan dat siliciumcarbide?  Labelen en detecteren van RNA-modificaties
Labelen en detecteren van RNA-modificaties Welk belangrijke functie moet een chemische vergelijking hebben om te worden geclassificeerd als verbrandingsreactie?
Welk belangrijke functie moet een chemische vergelijking hebben om te worden geclassificeerd als verbrandingsreactie?  Wat is de term voor beweging van oplosmiddelmoleculen van een hoge tot lage concentratie door een nieuw permeabel membraan?
Wat is de term voor beweging van oplosmiddelmoleculen van een hoge tot lage concentratie door een nieuw permeabel membraan?
 Welke landen zullen het meest waarschijnlijk een diepe duurzaamheidswending maken?
Welke landen zullen het meest waarschijnlijk een diepe duurzaamheidswending maken?  Geconfronteerd met uitdagingen op het gebied van waterveiligheid in de droge gebieden van de wereld
Geconfronteerd met uitdagingen op het gebied van waterveiligheid in de droge gebieden van de wereld Natuurlijke materialen gebruikt voor waterfiltratie
Natuurlijke materialen gebruikt voor waterfiltratie Hoe beschermt de atmosfeer van de aarde levende organismen?
Hoe beschermt de atmosfeer van de aarde levende organismen?  Team gebruikt machine learning om te bepalen welke bosbranden uit de hand lopen
Team gebruikt machine learning om te bepalen welke bosbranden uit de hand lopen
Hoofdlijnen
- Welke van de ketens aminozuren komt overeen met nucleotidesequentie UCA-AGC-GUA?
- Wat is het trechtervormige deel van je oor dat wordt genoemd?
- Begrijpen hoe de complexe levenscyclus van een krab zal reageren op klimaatverandering
- De elanden hoeden? Letse symbolische blauwe koe terug van de rand
- Kunnen data dolfijnen redden? Hoe wetenschappers NASA-gegevens gebruiken om het verband tussen zonnestormen en het stranden van dieren te bestuderen
- Welke chemische stof is verantwoordelijk voor het sturen van cellulaire processen?
- Later, alligator? Een vijfde van alle reptielensoorten zou kunnen uitsterven, zegt een nieuwe studie
- Wat is een organisme in actie en verandert het gedrag dat optreedt als gevolg van een stimulus?
- Wat is een andere naam voor een trofisch niveau?
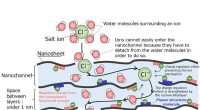
- Proces verwijdert tegelijkertijd giftige metalen en zout om schoon water te produceren

- Zeer functioneel membraan ontwikkeld voor de productie van zoetwater uit zeewater
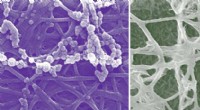
- Nieuwe cellulaire inzichten in botontwikkeling
- IJsbestendige coating voor grote constructies is afhankelijk van een prachtige demonstratie van mechanica

- Potentiële anti-verouderingscomponenten van Moringa oleifera blad
 Hoeveel Apollo -vluchten?
Hoeveel Apollo -vluchten?  Welke planeten zijn gasreus?
Welke planeten zijn gasreus?  Afbeelding:Internationaal ruimtestation reist door de maan
Afbeelding:Internationaal ruimtestation reist door de maan Leven met luchtvervuiling
Leven met luchtvervuiling Nieuwe superionische geleider van magnesium voor lithiumvrije solid-state batterijen
Nieuwe superionische geleider van magnesium voor lithiumvrije solid-state batterijen Wat is een voorbeeld van een detrital sedimentaryrock kalksteen breccia -verdamping of krijt?
Wat is een voorbeeld van een detrital sedimentaryrock kalksteen breccia -verdamping of krijt?  Voor sommige zwarte studenten, discriminatie woog zwaarder dan integratie voordelen
Voor sommige zwarte studenten, discriminatie woog zwaarder dan integratie voordelen Natuurkundigen ontwikkelen schaalbare methode om grafeen te maken
Natuurkundigen ontwikkelen schaalbare methode om grafeen te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

