
Wetenschap
Hoe verschillen polormoleculen van niet -polormoleculen?
Polaire moleculen
* Ongelijke verdeling van lading: Polaire moleculen hebben een ongelijke verdeling van de elektronendichtheid, wat betekent dat het ene uiteinde van het molecuul een gedeeltelijke positieve lading draagt (Δ+) en het andere uiteinde draagt een gedeeltelijke negatieve lading (Δ-).
* Oorzaak: Deze oneffenheid komt voort uit verschillen in elektronegativiteit tussen de atomen in het molecuul. Elektronegativiteit is het vermogen van een atoom om elektronen aan te trekken. Wanneer het ene atoom in een binding meer elektronegatief is dan het andere, trekt het de gedeelde elektronen dichterbij, waardoor een gedeeltelijke negatieve lading op dat atoom en een gedeeltelijke positieve lading op het minder elektronegatieve atoom ontstaat.
* Voorbeelden: Water (H₂o), ammoniak (NH₃), ethanol (ch₃ch₂oh), zoutzuur (HCl)
* eigenschappen:
* Hogere kookpunten: De gedeeltelijke ladingen in polaire moleculen stellen hen in staat om sterke dipool-dipool interacties te vormen, die meer energie vereisen om te breken.
* Oplosbaarheid in polaire oplosmiddelen: Polaire moleculen lossen goed op in polaire oplosmiddelen (zoals water) omdat ze sterke interacties kunnen vormen met de oplosmiddelmoleculen.
* Mogelijkheid om waterstofbindingen te vormen: Waterstofbindingen zijn een bijzonder sterk type dipool-dipoolinteractie die optreden wanneer waterstof wordt gebonden aan een sterk elektronegatief atoom zoals zuurstof of stikstof.
Niet -polaire moleculen
* zelfs ladingsverdeling: Niet -polaire moleculen hebben een evenwichtige verdeling van elektronen, dus er zijn geen gebieden met gelokaliseerde positieve of negatieve lading.
* Oorzaak: Dit gebeurt meestal wanneer de atomen in het molecuul vergelijkbare elektronegativiteiten hebben of wanneer het molecuul een symmetrische vorm heeft, waardoor potentiële polariteit wordt geannuleerd.
* Voorbeelden: Methaan (ch₄), koolstofdioxide (co₂), zuurstof (o₂), helium (HE)
* eigenschappen:
* Lagere kookpunten: Niet -polaire moleculen hebben zwakkere intermoleculaire krachten (van der Waals -krachten) dan polaire moleculen, waarvoor minder energie nodig is om uit elkaar te breken.
* Oplosbaarheid in niet -polaire oplosmiddelen: Niet -polaire moleculen lossen goed op in niet -polaire oplosmiddelen (zoals olie of hexaan) vanwege vergelijkbare intermoleculaire krachten.
* in het algemeen niet in staat om waterstofbruggen te vormen.
Sleutelverschil: De aanwezigheid of afwezigheid van een dipoolmoment (een maat voor de scheiding van ladingen) onderscheidt polaire en niet -polaire moleculen. Polaire moleculen bezitten een dipoolmoment, terwijl niet -polaire moleculen een nul dipoolmoment hebben.
Samenvattend: Het verschil tussen polaire en niet -polaire moleculen is de ongelijke (polaire) of zelfs (niet -polaire) verdeling van elektronendichtheid, wat resulteert in verschillende eigenschappen die verband houden met hun interacties met andere moleculen en hun fysieke gedrag.
 Verdeel en heers:onderzoekers vinden de sleutel tot het maken van betere medicijnen met minder bijwerkingen
Verdeel en heers:onderzoekers vinden de sleutel tot het maken van betere medicijnen met minder bijwerkingen Onderzoekers kijken naar interactie tussen olie en water om waterverontreiniging te voorkomen
Onderzoekers kijken naar interactie tussen olie en water om waterverontreiniging te voorkomen Waarom is Pangaea een supercontinent?
Waarom is Pangaea een supercontinent?  Wat veroorzaakt een toename van de snelheid van een chemische reactie tussen 2 vloeistoffen?
Wat veroorzaakt een toename van de snelheid van een chemische reactie tussen 2 vloeistoffen?  Welk gas ontstaat wanneer nikkel reageert met verdund zwavelzuur?
Welk gas ontstaat wanneer nikkel reageert met verdund zwavelzuur?
 Is er iets in de natuur dat paren groeit?
Is er iets in de natuur dat paren groeit?  Wat is familiezorg? Waarom het de voorkeur gaf aan Aboriginal-kinderen boven pleegkinderen
Wat is familiezorg? Waarom het de voorkeur gaf aan Aboriginal-kinderen boven pleegkinderen  Wat is de naam van een object dat slechts een beetje licht doorloopt?
Wat is de naam van een object dat slechts een beetje licht doorloopt?  Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen
Verbod op hoteltoiletartikelen is de nieuwste poging om plastic afval in te dammen Extreme overstromingen treffen Amerikaanse steden bijna dagelijks tegen 2100
Extreme overstromingen treffen Amerikaanse steden bijna dagelijks tegen 2100
Hoofdlijnen
- Wat is de hoogste en laagste taxonomische categorie?
- Wat zijn de effecten van levende organismen op het oppervlak?
- Wat is de buitenrand van plantencel en dierlijke cel?
- Welk instrument wordt gebruikt om een minuut organisme te bekijken?
- Hoe balsemen werkt
- Elektrontransportketen (ETC): definitie, locatie en belang
- Studie vindt hoe de overlevingstijd van stamcellen kan worden verlengd
- Waarom kan gistcel niet fotosynthet zijn?
- Welke cel is in staat om snel te bewegen als reactie op zijn omgeving?
- Video:wat is de chemie achter de zwangerschapstest thuis?
- Oplossen van molecuulinformatie in dynamisch lipidemembraan met meta-oppervlakken

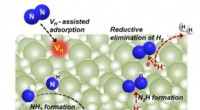
- Overgangsmetaalvrij bariumhydride medieert distikstoffixatie en ammoniaksynthese
- Wetenschappers gebruiken coöperatieve actie van een ligand-tegenionsysteem voor duurzame etherproductie

- Op Mars of de aarde, biohybride kan koolstofdioxide omzetten in nieuwe producten

 Verdeelt het superieure vliegtuig lichaam in rechter- en linkerhelften?
Verdeelt het superieure vliegtuig lichaam in rechter- en linkerhelften?  De magnetische singulariteit naderen
De magnetische singulariteit naderen NASA's Kepler is getuige van een superuitbarsting van het vampierstelsel
NASA's Kepler is getuige van een superuitbarsting van het vampierstelsel Hoe een hoek te berekenen van een lager
Hoe een hoek te berekenen van een lager  Waarom produceert de Hubble Space Telescope duidelijkere afbeeldingen dan die op aarde?
Waarom produceert de Hubble Space Telescope duidelijkere afbeeldingen dan die op aarde?  Wat is de eindpuntenergie van bètadeeltje?
Wat is de eindpuntenergie van bètadeeltje?  Sociale klasse dicteert nog steeds de banentrends voor afgestudeerden
Sociale klasse dicteert nog steeds de banentrends voor afgestudeerden Hoe testen wetenschappers hypothesen?
Hoe testen wetenschappers hypothesen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

