
Wetenschap
Welk type opgeloste stof zit er in een oplossing die elektriciteit leidt?
Dit is waarom:
* elektrolyten zijn stoffen die dissociëren in ionen wanneer opgelost in een oplosmiddel. Deze ionen zijn geladen deeltjes die vrij kunnen bewegen, waardoor de oplossing elektriciteit kan leiden.
* niet -elektrolyten zijn stoffen die niet dissociëren in ionen wanneer opgelost. Ze blijven als neutrale moleculen, dus de oplossing kan geen elektriciteit leiden.
Voorbeelden van elektrolyten:
* zouten: Tafelzout (NaCl) lost op in Na+ en clies.
* zuren: Hydrochloorzuur (HCL) lost op in H+ en clies.
* Bases: Natriumhydroxide (NaOH) lost op in Na+ en OH-ionen.
Voorbeelden van niet -elektrolyten:
* Sugar: Sucrose (C12H22O11) lost op maar vormt geen ionen.
* ethanol: Ethanol (C2H5OH) lost op maar vormt geen ionen.
Belangrijke opmerking: De sterkte van de elektrische geleidbaarheid hangt af van de concentratie van de elektrolyt en de mobiliteit van de ionen.
Hoofdlijnen
- Zijn eicellencellen haploïd of diploïd?
- Onderzoeken hoe toekomstige biologieleraren debatteren over controversiële kwesties
- Wat planten nodig hebben om droogte te weerstaan
- Wat is de belangrijkste rol van suiker in levende wezens?
- Hoe kan biotechnologie de opwarming van de aarde stoppen?
- DNA-reparatie na CRISPR-snijden helemaal niet wat mensen dachten
- Probiotische combinatie verbetert de overleving van oesterlarven drastisch
- Onderzoekers ontdekken dat het nauwkeurig transcriberen van DNA het herstel van DNA opheft
- Welke eigenschap wordt uitgedrukt wanneer twee verschillende genen voor hetzelfde aanwezig zijn opgeroepen?
- Een milieuvriendelijke techniek om metaalafval te recyclen tot multifunctionele aerogels

- Kunstmatig geproduceerde cellen communiceren met elkaar

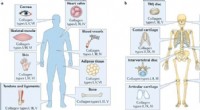
- Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes
- Ingenieur-kliniekteam gebruikt actieve rimpels om synthetische transplantaten schoon te houden

- De fundamentele aard van defecten op atomaire schaal begrijpen
 Philly-start-up Kapsul maakt een stillere airconditioner dankzij $ 2,3 miljoen van crowdfunding
Philly-start-up Kapsul maakt een stillere airconditioner dankzij $ 2,3 miljoen van crowdfunding 15 C graden omrekenen naar Fahrenheit?
15 C graden omrekenen naar Fahrenheit?  Nationale abortusstudie vindt out-of-touch labels, kennislacunes, honger naar morele discussie
Nationale abortusstudie vindt out-of-touch labels, kennislacunes, honger naar morele discussie Machines op nanoschaal voorbereiden
Machines op nanoschaal voorbereiden Hoe verandert de atomaire theorie van het koers van de wereldgeschiedenis?
Hoe verandert de atomaire theorie van het koers van de wereldgeschiedenis?  Wie was de eerste Britten verkend om de Zuidpool te bereiken?
Wie was de eerste Britten verkend om de Zuidpool te bereiken?  Hoe lang voor de maan door Jumbo Jet?
Hoe lang voor de maan door Jumbo Jet?  Astronomen onderzoeken breedbandvariabiliteit van de blazar Markarian 501
Astronomen onderzoeken breedbandvariabiliteit van de blazar Markarian 501
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


