
Wetenschap
Wat is de eigenschappen van een zuur?
1. Smaak: Zuren hebben een zure smaak. Dit is hoe het woord "zuur" zelf is ontstaan, omdat het Latijnse woord "acidus" "zuur" betekent.
2. Ph: Zuren hebben een pH -waarde minder dan 7. De pH -schaal meet de zuurgraad of alkaliteit van een oplossing. Hoe lager de pH, hoe sterker het zuur.
3. Reactie met basen: Zuren reageren met basen om zouten en water te vormen in een proces dat neutralisatie wordt genoemd. Dit is een belangrijke eigenschap die wordt gebruikt om de effecten van zuren tegen te gaan.
4. Reactie met metalen: Veel zuren reageren met actieve metalen (zoals zink, magnesium en ijzer) om waterstofgas en een zout te produceren. Deze reactie is een gebruikelijke manier om waterstofgas in het laboratorium te genereren.
5. Leed elektriciteit: Zuren leiden elektriciteit wanneer opgelost in water, vanwege de aanwezigheid van ionen.
6. Draai lakmus papier rood: Lakmuspapier is een pH -indicator. Wanneer het in een zure oplossing wordt ondergedompeld, wordt het rood.
7. Reageer met carbonaten: Zuren reageren met carbonaten (zoals calciumcarbonaat) om koolstofdioxidegas, water en een zout te produceren. Deze reactie is verantwoordelijk voor het bruisen wanneer u azijn (azijnzuur) toevoegt aan bakpoeder (natriumbicarbonaat).
Andere eigenschappen:
* Corrosiviteit: Sommige zuren zijn corrosief en kunnen materialen zoals huid, metalen en stoffen beschadigen.
* dehydraterende eigenschappen: Sommige geconcentreerde zuren kunnen water uit moleculen verwijderen, een proces dat uitdroging wordt genoemd.
* Oxiderende eigenschappen: Sommige zuren fungeren als oxidatiemiddelen, wat betekent dat ze elektronen uit andere stoffen kunnen krijgen.
Belangrijke opmerking: Zuren zijn gevaarlijk en moeten voorzichtig worden afgehandeld. Draag altijd de juiste veiligheidsuitrusting en volg de juiste hanteringsprocedures bij het werken met zuren.
 Onderzoekers bestuderen kooien van synthetische eiwitten
Onderzoekers bestuderen kooien van synthetische eiwitten Nadat we ontdekten dat uw alkaliteit te laag was, hebben we de alkaliteit verhoogd. Hoe lang duurt het voordat de troebelheid verdwijnt? Alle andere chemicaliën waren perfect?
Nadat we ontdekten dat uw alkaliteit te laag was, hebben we de alkaliteit verhoogd. Hoe lang duurt het voordat de troebelheid verdwijnt? Alle andere chemicaliën waren perfect?  Is CaSO4 ionisch of covalent gebonden?
Is CaSO4 ionisch of covalent gebonden?  Is een goed gekookte steak chemische of fysieke verandering?
Is een goed gekookte steak chemische of fysieke verandering?  Welke term wordt gebruikt om het delen van valentie -elektronen tussen twee of meer atomen te beschrijven?
Welke term wordt gebruikt om het delen van valentie -elektronen tussen twee of meer atomen te beschrijven?
 Bacteriën kunnen meer bijdragen aan klimaatverandering naarmate de planeet warmer wordt
Bacteriën kunnen meer bijdragen aan klimaatverandering naarmate de planeet warmer wordt Onderzoekers tonen aan dat bedreigde papegaaiensoorten het goed doen in stedelijke gebieden
Onderzoekers tonen aan dat bedreigde papegaaiensoorten het goed doen in stedelijke gebieden  Toen de ijstijd eindigde, was het land bedekt meestal?
Toen de ijstijd eindigde, was het land bedekt meestal?  Snake Allergieën
Snake Allergieën  Koolstofput in tropische bossen wordt al snel zwakker
Koolstofput in tropische bossen wordt al snel zwakker
Hoofdlijnen
- Welke term definieert een proces waarmee gunstige eigenschappen van een organisme vaker voorkomen in opeenvolgende generaties en ongunstig minder gebruikelijk?
- Hoe snelheid de evolutionaire verandering van de wervelkolom bij zoogdieren beperkt
- Wat zijn isostopes?
- Wat vangt externe energie en converteert het in de cel?
- Een bèta -deeltje is een wat is gecreëerd en uitgestoten uit een onstabiele kern?
- Wat is een conclusie?
- Radiologie werpt licht op oude vissoorten coelacanth
- Is het enzym waarmee replicatie DNA -polymerase of RNA -polymerase kan optreden?
- Nieuwe minimaal invasieve procedure redt het leven van honden - en haar nier
- Eilanden zonder structuur in metaallegeringen kunnen leiden tot hardere materialen
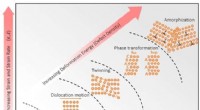
- Blauw pigment van kunstmatige schimmels kan de textielindustrie groener maken

- Kristallografie biedt blauwdrukken voor gevechtsplannen voor het aanvallen van ziekteverwekkende bacteriën
- St. Janskruid bloemen dienen als groene katalysator

- Video:Waarom durian de stinkende koning van fruit is

 Het sorteren van de neppers van het sociale netwerk van de verhuizers en shakers
Het sorteren van de neppers van het sociale netwerk van de verhuizers en shakers Waarom is water neutraal belangrijk?
Waarom is water neutraal belangrijk?  Vijf tips om een goede mentor te zijn voor iemand die twee keer zo oud is als jij
Vijf tips om een goede mentor te zijn voor iemand die twee keer zo oud is als jij Hoe lang duurt de zon om PLUTO te draaien?
Hoe lang duurt de zon om PLUTO te draaien?  Hoe wordt de continue stroom van lading genoemd?
Hoe wordt de continue stroom van lading genoemd?  Wat levert energie op voor een kerncentrale?
Wat levert energie op voor een kerncentrale?  De nacht was zo donker tegen die tijd dat het tot de ochtend zou zijn en welk licht we leken meer uit de rivier te komen dan hemeren in hun dompel die op een paar gereflecteerde sterren werd geslagen. De?
De nacht was zo donker tegen die tijd dat het tot de ochtend zou zijn en welk licht we leken meer uit de rivier te komen dan hemeren in hun dompel die op een paar gereflecteerde sterren werd geslagen. De?  Wat gebeurt er als een vaste stof rechtstreeks in gas verandert?
Wat gebeurt er als een vaste stof rechtstreeks in gas verandert?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

