
Wetenschap
Wat zou de evenwichtsconcentratie van NO zijn in een gasmengsel dat 1,7 m SO3 0,070 SO2 en 1,3 NO2 bevat als KEQ 10.8 onder die omstandigheden?
1. Schrijf de gebalanceerde chemische vergelijking en de evenwichtsuitdrukking:
De evenwichtige chemische vergelijking voor de reactie is:
`` `
SO3 (G) + NO (G) ⇌ SO2 (G) + NO2 (G)
`` `
De evenwichtsuitdrukking is:
`` `
Keq =([so2] [no2]) / ([so3] [nee])
`` `
2. Zet een ijstafel in:
| | SO3 | Nee | SO2 | NO2 |
| ------- | ------- | ------- | ------- | ------- |
| Eerste | 1.7 m | 0 | 0,070 m | 1.3 m |
| Verandering | -x | -x | +x | +x |
| Equil | 1.7-X | -x | 0,070+x | 1.3+x |
3. Vervang de evenwichtsconcentraties in de evenwichtsuitdrukking:
`` `
10.8 =((0.070 + x) (1.3 + x)) / ((1.7 - x) (x))
`` `
4. Oplossen voor x:
Deze vergelijking is een kwadratische vergelijking. U kunt het oplossen met behulp van de kwadratische formule of door de vergelijking te vereenvoudigen en benaderingen te maken.
* benadering: Omdat KEQ relatief groot is, kunnen we aannemen dat de verandering in concentratie (x) klein is in vergelijking met de initiële concentraties van SO3, SO2 en NO2. Hierdoor kunnen we de vergelijking vereenvoudigen:
`` `
10.8 ≈ (0.070 * 1.3) / (1.7 * x)
`` `
* Oplossen voor x:
`` `
x ≈ (0,070 * 1.3) / (10.8 * 1.7) ≈ 0,0053 m
`` `
5. Bereken de evenwichtsconcentratie van NO:
`` `
[Nee] =-x ≈ -0,0053 m
`` `
Omdat de concentratie niet negatief kan zijn, geeft dit aan dat onze benadering niet geldig was. We moeten de volledige kwadratische vergelijking oplossen.
Het oplossen van de kwadratische vergelijking:
1. Breid de vergelijking uit van stap 3.
2. Herschik het in een standaard kwadratische vorm (ax² + bx + c =0).
3. Gebruik de kwadratische formule om op te lossen voor x.
Belangrijk: De kwadratische formule geeft u twee oplossingen voor x. U moet de oplossing kiezen die fysiek zinvol is (d.w.z. een positieve waarde voor [nee]).
Na het oplossen van de kwadratische vergelijking krijgt u de evenwichtsconcentratie van nr.
Hoofdlijnen
- Kunnen inheemse bijen, nu de kolonies van honingbijen instorten, de bestuiving aan?
- Welk type cel is een rozennel?
- Aten moderne mensen Neanderthalers?
- Onderzoekers ontdekken wat er bij libellen op het menu staat
- Hoe worden natuurlijke selectie en evolutie gekoppeld?
- Wat zijn de 16 verschillende organismen die evolutie vertegenwoordigen van cel tot mens?
- Waar en hoe een eatherquake optreedt?
- Nieuwe bevindingen uit onderzoek naar kunstmatige selectie wijzen op een bedreiging voor mariene omgevingen
- Hoe signaalmoleculen voor de vorming van verschillende celtypen worden aangestuurd
- Onderzoekers ontwikkelen nieuwe chip voor superieure forensische detectie van bloedresten

- Tweaks achter de wedergeboorte van bijna afgedankte organische zonnetechnologieën

- Ingenieurs 3D-print vormveranderende slimme gel

- De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
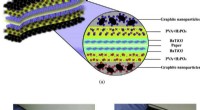
- Een eenvoudig, goedkoop materiaal voor het afvangen van koolstof, misschien uit uitlaatpijpen

 Welke planeet heeft sinds zijn ontdekking geen baan rond de zon voltooid?
Welke planeet heeft sinds zijn ontdekking geen baan rond de zon voltooid?  Bereken de energie die vrijkomt bij de vorming van één mol bindingen, geen rooster. De straal magnesiumion is 1,60 en selenide 1,26. Merk dat op?
Bereken de energie die vrijkomt bij de vorming van één mol bindingen, geen rooster. De straal magnesiumion is 1,60 en selenide 1,26. Merk dat op?  Wat is een isotone oplossing?
Wat is een isotone oplossing?  Campylobacter gebruikt andere organismen als Trojaans paard om nieuwe gastheren te infecteren
Campylobacter gebruikt andere organismen als Trojaans paard om nieuwe gastheren te infecteren Wat is een eenheid die wordt gebruikt om energie te meten?
Wat is een eenheid die wordt gebruikt om energie te meten?  Grote bosbranden bedreigen steden in Montana, Californië
Grote bosbranden bedreigen steden in Montana, Californië Hoe reageren groene algen op koolstofnanobuisjes?
Hoe reageren groene algen op koolstofnanobuisjes? Lineaire meters converteren naar lineaire voeten
Lineaire meters converteren naar lineaire voeten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


