
Wetenschap
Is de relatie tussen temperatuur en oplosbaarheid hetzelfde voor Epsom -zout?
Dit is waarom:
* de meeste zouten: Voor de meeste ionische verbindingen neemt de oplosbaarheid toe met toenemende temperatuur. Dit komt omdat de toegevoegde energie uit warmte helpt de bindingen te verbreken die de ionen bij elkaar houden in het kristalrooster, waardoor ze gemakkelijker kunnen oplossen.
* Epsom -zout (MgSO4): Epsom -zout vertoont Retrograde oplosbaarheid . Dit betekent dat de oplosbaarheid ervan * afneemt * met toenemende temperatuur.
Verklaring voor retrograde oplosbaarheid:
* Hydratatie: Magnesiumsulfaat vormt gehydrateerde zouten, wat betekent dat watermoleculen binden aan de MGSO4 -moleculen.
* evenwicht: De oplossing van MGSO4 is een evenwichtsproces:
MgSO4 (s) + H2O (l) ⇌ mg2 + (aq) + SO42- (aq)
* Temperatuureffect: Wanneer de temperatuur toeneemt, verschuift het evenwicht naar links (naar de vaste MgSO4). Dit komt omdat de gehydrateerde magnesiumsulfaationen sommige van hun watermoleculen verliezen als gevolg van verhoogde thermische energie, wat leidt tot een afname van de oplosbaarheid.
Samenvattend:
* de meeste zouten: De oplosbaarheid neemt toe met de temperatuur.
* Epsom -zout (MgSO4): De oplosbaarheid neemt af met temperatuur (oplosbaarheid van retrograde).
Dit gedrag maakt EPSOM -zout uniek en is een interessant voorbeeld van hoe temperatuur de oplosbaarheid op verschillende manieren voor verschillende verbindingen kan beïnvloeden.
 Wat is het metaal dat het moeilijkst te breken is?
Wat is het metaal dat het moeilijkst te breken is?  Wat zijn voorbeelden van moleculaire stoffen?
Wat zijn voorbeelden van moleculaire stoffen?  Onderzoekers creëren een paradigmaverschuiving in de categorisatie van actieve locaties van katalysatoren, waardoor deuren worden geopend naar nieuw katalysatorontwerp
Onderzoekers creëren een paradigmaverschuiving in de categorisatie van actieve locaties van katalysatoren, waardoor deuren worden geopend naar nieuw katalysatorontwerp  Wetenschappers onthullen stapsgewijze hydratatiemotieven van zwaveldioxide
Wetenschappers onthullen stapsgewijze hydratatiemotieven van zwaveldioxide Zoutwater is een soort goed gemengd mengsel genaamd een?
Zoutwater is een soort goed gemengd mengsel genaamd een?
 De koppelingsrelatie tussen verstedelijking en de eco-omgeving in stedelijke agglomeratie
De koppelingsrelatie tussen verstedelijking en de eco-omgeving in stedelijke agglomeratie Hoe het beheer van stikstofmeststoffen de bodemconcentratie en oppervlakteflux beïnvloedt
Hoe het beheer van stikstofmeststoffen de bodemconcentratie en oppervlakteflux beïnvloedt Nieuwe kaart voor radioactieve bodemverontreiniging in West-Europa
Nieuwe kaart voor radioactieve bodemverontreiniging in West-Europa Hoe 'ethische beïnvloeders' hun publiek betrekken bij het redden van de planeet
Hoe 'ethische beïnvloeders' hun publiek betrekken bij het redden van de planeet  Irrigatie verlicht extreme hitte
Irrigatie verlicht extreme hitte
Hoofdlijnen
- Een 3D-plantencel maken
- Wat betekent onderlinge afhankelijkheid in de wetenschap?
- Hoe is eten gerelateerd aan de wetenschap?
- Wat zijn de feiten over evolutie?
- Overlevingsstrategie van boodschapper-RNA's tijdens cellulair suikertekort
- Hoe zou je de functie van het voortplantingssysteem omschrijven?
- Waarom wordt micro-evolutie beweerd door creationisten en evolutiewetenschappers?
- Wat heeft Rosalind Franklin te maken met genetica?
- Hoe wetenschappers ons hebben gered van de ineenstorting van de sint-jakobsschelp
- Mini-centrifuge voor eenvoudigere studie van bloedcellen opent nieuwe organ-on-chip mogelijkheden

- Team onthult verrassende details van cruciaal energieproducerend enzym

- Vlamvertragers - van planten

- Gebruik maken van de slagvastheid van 's werelds hardste beton voor rampenpreventie
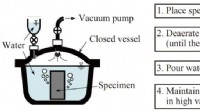
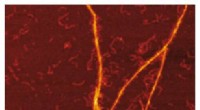
- S100A9-amyloïden op Aβ-fibrillaire oppervlakken onthuld
 Een huis dat zichzelf bestuurt? Samsung vindt dat het tijd wordt
Een huis dat zichzelf bestuurt? Samsung vindt dat het tijd wordt  Wie waren de personages in een wolk met een zilveren rand?
Wie waren de personages in een wolk met een zilveren rand?  Door de natuur geïnspireerde proteïne kan helpen bij de plasticplaag
Door de natuur geïnspireerde proteïne kan helpen bij de plasticplaag Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid
Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid Oude Antarctische ijssmelt verhoogde de zeespiegel met meer dan 3 meter - en het zou opnieuw kunnen gebeuren
Oude Antarctische ijssmelt verhoogde de zeespiegel met meer dan 3 meter - en het zou opnieuw kunnen gebeuren Wat is de deinitie van Nebula?
Wat is de deinitie van Nebula?  Wat is fotosynthetisch membraan?
Wat is fotosynthetisch membraan?  Een stap dichter bij biotechnologische vervangingen voor vaten en kanalen
Een stap dichter bij biotechnologische vervangingen voor vaten en kanalen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

