
Wetenschap
Is natriumchloride polair of niet, je bent in de war omdat sommigen zeggen dat het en polair is?
* ionische binding: Natriumchloride vormt zich door ionische binding. Natrium (NA) verliest gemakkelijk een elektron om een positief geladen ion (Na+) te worden, terwijl chloor (CL) gemakkelijk een elektron krijgt om een negatief geladen ion te worden (Cl-). De sterke elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen vormt de ionische binding.
* Polaire covalente binding: Polaire covalente bindingen treden op wanneer elektronen ongelijk worden gedeeld tussen twee atomen met verschillende elektronegativiteiten. Dit creëert een gedeeltelijke positieve lading op het ene atoom en een gedeeltelijke negatieve lading aan het andere. Natriumchloride vertoont dit type binding niet.
Waarom de verwarring?
* Oplosbaarheid in water: Natriumchloride lost gemakkelijk op in water, wat een polair oplosmiddel is. Dit leidt ertoe dat sommigen denken dat het ook polair moet zijn. Dit is echter te wijten aan de sterke aantrekkingskracht tussen de watermoleculen en de geladen ionen in het zout, waardoor ze kunnen scheiden en omgeven worden door watermoleculen.
* kristalstructuur: De kristalstructuur van natriumchloride creëert een opstelling waarbij de positieve en negatieve ladingen gelijkmatig worden verdeeld. Dit kan ertoe leiden dat sommigen denken dat het molecuul zelf polair is, maar het is echt de ionische aard van de verbinding die resulteert in deze regeling.
Samenvattend:
Hoewel natriumchloride oplost in water en de kristalstructuur een misleidende indruk kan geven, is het belangrijk om te onthouden dat natriumchloride een ionische verbinding is, geen polair molecuul.
 Welk soort kracht kan dingen aantrekken?
Welk soort kracht kan dingen aantrekken?  Papegaai waarvan men dacht dat hij uitgestorven was en die 100 jaar geleden werd herontdekt. Wat daarna volgde, is een tragedie die we niet mogen herhalen
Papegaai waarvan men dacht dat hij uitgestorven was en die 100 jaar geleden werd herontdekt. Wat daarna volgde, is een tragedie die we niet mogen herhalen  Nivea-moeder Beiersdorf stapt over op groene stroom
Nivea-moeder Beiersdorf stapt over op groene stroom Hoe helpt het trekken van onkruid de aarde?
Hoe helpt het trekken van onkruid de aarde?  In Parijs, het risico op overstromingen is nooit ver weg
In Parijs, het risico op overstromingen is nooit ver weg
Hoofdlijnen
- Wat maakt een held?
- Zijn pH-niveau en enzymen gerelateerd?
- Waarom is DNA belangrijk voor levende wezens?
- Vleesetende planten inspireren slimme gladde oppervlakken en bionische robots
- Waarom is het Golgi-apparaat belangrijk en welke taak heeft het apparaat ons in ons lichaam geholpen?
- Waarom heet de mens omnivore?
- Hoe kun je zien of een cel chlorofyl bevat?
- Hoe te metaboliseren glucose om ATP te maken
Energie opgeslagen in de chemische bindingen van de koolhydraat-, vet- en eiwitmoleculen in levensmiddelen. Het proces van spijsvertering breekt koolhydraatmoleculen af in glucosemoleculen. Glucose die
- Basen van DNA zijn met elkaar verbonden door intermoleculaire krachten, genaamd?
- Nieuwe koolwaterstofbrandstofcellen met hoog rendement en lage kosten
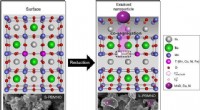
- Bacterieval kan antibioticaresistentie helpen vertragen
- Niet te nat, niet te droog - met plasma behandelde brandstofcel doet het precies goed

- Kaasmaken kan de sleutel zijn tot gezondere baby's en het bestrijden van ziektes

- Materiaal met hoge brekingsindex behoudt een hoge doorlaatbaarheid na uitgloeien bij 850 ° C

 Wat voor soort telescoop is de Hubble -telescoop?
Wat voor soort telescoop is de Hubble -telescoop?  Waarom neemt de druk af als het volume toeneemt?
Waarom neemt de druk af als het volume toeneemt?  Is waterkracht duur in vergelijking met andere vormen van energie?
Is waterkracht duur in vergelijking met andere vormen van energie?  Sommige voedselverontreiniging begint in de bodem
Sommige voedselverontreiniging begint in de bodem Gassen scheiden met flexibele moleculaire zeven
Gassen scheiden met flexibele moleculaire zeven De ontdekking van wetenschappers maakt de weg vrij voor nieuwe ultrasnelle kwantumcomputers
De ontdekking van wetenschappers maakt de weg vrij voor nieuwe ultrasnelle kwantumcomputers Verschillende soorten anemometers
Verschillende soorten anemometers  Verschil tussen waterstofperoxide en benzoylperoxide
Verschil tussen waterstofperoxide en benzoylperoxide
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

