
Wetenschap
Is H2S BR2 ----- 2HBR S Redox-reactie?
* oxidatie: Zwavel in H₂s gaat van een oxidatietoestand van -2 naar 0 in elementaire zwavel (s). Dit is een toename van de oxidatietoestand, wat duidt op oxidatie.
* reductie: Bromine in BR₂ gaat van een oxidatietoestand van 0 naar -1 in HBR. Dit is een afname van de oxidatietoestand, wat wijst op reductie.
Verklaring:
* H₂s: In H₂s bevindt zwavel zich in de -2 -oxidatietoestand (waterstof is +1).
* br₂: In Br₂ bevindt Bromine zich in de 0 oxidatietoestand (elementaire vorm).
* HBR: In HBR bevindt Bromine zich in de -1 -oxidatietoestand (waterstof is +1).
* s: Elementaire zwavel heeft een oxidatietoestand van 0.
Over het algemeen:
* Zwavel in H₂s verliest elektronen (oxidatie) en wordt geoxideerd tot elementaire zwavel (s).
* Bromine in BR₂ wint elektronen (reductie) en wordt gereduceerd tot bromide-ionen (Br-) in HBR.
Daarom is de reactie een redox -reactie omdat het de overdracht van elektronen tussen reactanten omvat.
 Reageert jodium in een zoutzuuroplossing?
Reageert jodium in een zoutzuuroplossing?  Is lood een allotroop van koolstof?
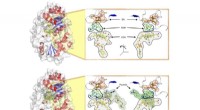
Is lood een allotroop van koolstof?  Zelfassemblerende homo-oligomeren van cyclische eiwitten
Zelfassemblerende homo-oligomeren van cyclische eiwitten Welke twee kenmerken worden aangegeven door de kleurcodering in periodieke tabel?
Welke twee kenmerken worden aangegeven door de kleurcodering in periodieke tabel?  Hoe katalysatoren worden gebruikt in de landbouw van de indydry of de behandeling van besmet bodemafvalwater?
Hoe katalysatoren worden gebruikt in de landbouw van de indydry of de behandeling van besmet bodemafvalwater?
 Waarom verliezen deeltjes hun aantrekkingskracht en veranderen ze van de ene toestand naar de andere?
Waarom verliezen deeltjes hun aantrekkingskracht en veranderen ze van de ene toestand naar de andere?  Wat is het flora Elbem van New South Wales?
Wat is het flora Elbem van New South Wales?  Is Sandalwood een voorbeeld van onthoofde bos?
Is Sandalwood een voorbeeld van onthoofde bos?  Diversiteit of achterstelling – wat een ‘slechte’ buurt maakt
Diversiteit of achterstelling – wat een ‘slechte’ buurt maakt  Op welke manieren verschilt de klimaatwetenschap van traditionele wetenschappen zoals chemie en biologie?
Op welke manieren verschilt de klimaatwetenschap van traditionele wetenschappen zoals chemie en biologie?
Hoofdlijnen
- Waarom worden introns gekopieerd en vervolgens verwijderd uit de RNA -sequentie?
- Wat is het orgaan van reproductie in zulke bloeiende planten als Crocus en Gladiolus?
- Bestaat er echt een ‘mama’-gen bij vrouwen?
- Wat helpt kleine plantachtige organismen te groeien op het oppervlak van de oceaan?
- Wat zijn de soorten verdamping en de definitie ervan?
- Wat betekent -ose in de wetenschappelijke woordenschat?
- Dode vissen blazen nieuw leven in de evolutionaire oorsprong van vinnen en ledematen
- Wat is het LRAGE -ogran in uw lichaam?
- Hoe diabetes werkt
- Geminiaturiseerde lab-on-a-chip voor realtime chemische analyse van vloeistoffen
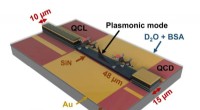
- Hoe een bepaald eiwit tot tweederde van de methaanemissie ter wereld regelt
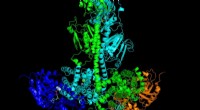
- Onderzoekers lossen eiwitstructuur op die verband houdt met erfelijke netvliesaandoeningen
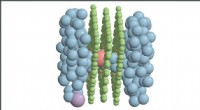
- Supercomputers sturen onderzoek naar ionentransport aan
- Nieuwe katalysator voldoet aan de uitdaging om uitlaatgassen van moderne motoren te reinigen

 Grafeen ontladen en moleculaire afscherming
Grafeen ontladen en moleculaire afscherming Synthetisch materiaal werkt als een apparaat om insecten te verhullen
Synthetisch materiaal werkt als een apparaat om insecten te verhullen Doel voorbij winst:hoe merken het welzijn van de consument ten goede kunnen komen
Doel voorbij winst:hoe merken het welzijn van de consument ten goede kunnen komen  Wat is deze laag van de korst graniet gemaakt?
Wat is deze laag van de korst graniet gemaakt?  Waarom paraffineolie in instrument gebruiken terwijl het smeltpunt van benzoëzuur bekend is?
Waarom paraffineolie in instrument gebruiken terwijl het smeltpunt van benzoëzuur bekend is?  Een nieuw soort vaccin op basis van spinrag
Een nieuw soort vaccin op basis van spinrag Wat is tangentiële snelheid en versnelling?
Wat is tangentiële snelheid en versnelling?  Cyprus ontdekt eerste ongestoord Romeins scheepswrak
Cyprus ontdekt eerste ongestoord Romeins scheepswrak
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

