
Wetenschap
Wat zijn dichter harder hebben hogere smeltpunten en iets minder actief dan alkali -metalen in dezelfde periode?
* Denser: Alkalische aardmetalen zijn dichter dan alkali -metalen omdat ze een kleinere atoomradius en een groter aantal protonen in hun kern hebben, wat leidt tot een sterkere aantrekkingskracht tussen de kern en elektronen.
* harder: De sterkere metallische binding in alkalische aardmetalen maakt ze harder dan alkali -metalen.
* Hogere smeltpunten: De sterkere metalen binding draagt ook bij aan hogere smeltpunten voor alkalische aardmetalen.
* iets minder actief: Alkalische aardmetalen hebben een lagere reactiviteit dan alkali -metalen. Dit komt omdat ze twee valentie -elektronen hebben, die minder gemakkelijk kunnen worden verwijderd dan het enkele valentie -elektron van alkali -metalen.
Voorbeelden van alkalische aardmetalen omvatten:
* Beryllium (be)
* Magnesium (mg)
* Calcium (CA)
* Strontium (SR)
* Barium (BA)
* Radium (ra)
Laat het me weten als je meer wilt weten over een van deze eigenschappen!
 Uit welke stoffen bestaat een covalente stof?
Uit welke stoffen bestaat een covalente stof?  Hoe produceren de elementen natrium en chloor het samengestelde chloride?
Hoe produceren de elementen natrium en chloor het samengestelde chloride?  Lucht niet hetzelfde als zuurstof?
Lucht niet hetzelfde als zuurstof?  Video:Er zit goud in zeewater! Kunnen we het extraheren?
Video:Er zit goud in zeewater! Kunnen we het extraheren? Heterogene ethyleenhydroformylering maakt een zeer efficiënte industriële productie van propanal/n-propanol mogelijk
Heterogene ethyleenhydroformylering maakt een zeer efficiënte industriële productie van propanal/n-propanol mogelijk
 Een kwantitatieve momentopname van de menselijke impact op de planeet
Een kwantitatieve momentopname van de menselijke impact op de planeet Rapport schetst groeiende klimaatveranderingsgerelateerde bedreigingen voor het gebied van de Grote Meren
Rapport schetst groeiende klimaatveranderingsgerelateerde bedreigingen voor het gebied van de Grote Meren Potentieel schadelijke luchtverontreiniging nabij New Bedford Harbor
Potentieel schadelijke luchtverontreiniging nabij New Bedford Harbor 10 dingen die u kunt doen om de aarde te helpen redden
10 dingen die u kunt doen om de aarde te helpen redden  De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen
De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen
Hoofdlijnen
- Hoe is selectief fokken een vorm van biotechnologie?
- Waarom vormen wetenschappers een hypothese?
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Maki-darm is niet één ecosysteem, het zijn er veel
- Biologen onthullen hoe gyrase DNA-verstrengelingen oplost
- Wat is de functie van choloroplast?
- Hoe moleculaire spieren cellen helpen delen
- Klop, klop! Wie is daar?
- Biologen werpen licht op hoe cellen hulpbronnen verplaatsen
- Groot tinmonosulfidekristal opent weg voor volgende generatie zonnecellen

- Spoor, doelwit, trigger:wetenschappers onderzoeken gecontroleerde CO-afgifte
- Nieuwe technologie zet biomassa om in steenkool

- Moleculaire structuur voorspeld door vroege Nobelprijswinnaar gevonden na een eeuw
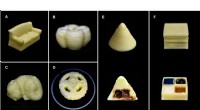
- Onderzoekers ontwikkelen eenvoudige methode om melkproducten in 3D te printen
 Jacob nam een kompas- en rasterpatroonkaart mee toen hij?
Jacob nam een kompas- en rasterpatroonkaart mee toen hij?  Onderzoeksteam creëert nieuw magnetisch quasideeltje
Onderzoeksteam creëert nieuw magnetisch quasideeltje  Hoe worden materialen van de aarde genoemd?
Hoe worden materialen van de aarde genoemd?  Transparant geleidend materiaal kan leiden tot stroomopwekkende ramen
Transparant geleidend materiaal kan leiden tot stroomopwekkende ramen Evolutie van een bimetaal nanokatalysator
Evolutie van een bimetaal nanokatalysator Komt de bio -synthese van ribosomale subeenheden voor in kern?
Komt de bio -synthese van ribosomale subeenheden voor in kern?  Hoeveel woorden kunt u maken van vulkanen?
Hoeveel woorden kunt u maken van vulkanen?  UITLEG:Waarom South 's nachts meer dodelijke tornado's krijgt
UITLEG:Waarom South 's nachts meer dodelijke tornado's krijgt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

