
Wetenschap
Waarom wordt waterstof in de eerste groep geplaatst als het een niet -metaal is?
* Elektronenconfiguratie: Waterstof heeft slechts één elektron, net als de alkali -metalen in groep 1. Dit enkele elektron bezet zijn 1s orbitaal, vergelijkbaar met lithium, natrium, enz. Deze gedeelde elektronenconfiguratie is waarom waterstof zich vaak gedraagt als een metaal in chemische reacties.
* Reactiviteit: Waterstof kan zijn elektron verliezen en een positief ion (H+) vormen, vergelijkbaar met alkali -metalen. Hierdoor kan het ionische verbindingen zoals HCl (zoutzuur) vormen.
* Fysieke eigenschappen: Hoewel waterstof een gas is bij kamertemperatuur, deelt het niet de metalen eigenschappen van de alkali -metalen.
Het dilemma:
Waterstof vertoont enkele kenmerken van zowel metalen als niet -metalen. Dit maakt zijn plaatsing uitdagend.
* Groep 1: De elektronenconfiguratie en de mogelijkheid om ionische verbindingen te vormen, maken het soms passend bij de alkali -metalen.
* Groep 17: Waterstof kan ook een elektron krijgen om het hydride-ion (H-) te vormen, vergelijkbaar met halogenen.
De oplossing:
Waterstof wordt vaak bovenaan groep 1 geplaatst, maar het is belangrijk om te onthouden dat het een speciaal geval is. Het wordt soms afzonderlijk gepresenteerd van de rest van de tabel of boven beide groepen 1 en 17 geplaatst om de unieke aard ervan te benadrukken.
Laat het me weten als je nog andere vragen hebt!
 Opwarmende planeet leidde tot veenvorming
Opwarmende planeet leidde tot veenvorming Risico's verminderen en rampen voorkomen - grid 2.0 . creëren
Risico's verminderen en rampen voorkomen - grid 2.0 . creëren Zal het lonen van een koolstofarm pad lonend zijn voor Californië?
Zal het lonen van een koolstofarm pad lonend zijn voor Californië? Hoe beïnvloeden meren energie, warmte, en koolstofuitwisselingsprocessen in bergachtige gebieden?
Hoe beïnvloeden meren energie, warmte, en koolstofuitwisselingsprocessen in bergachtige gebieden? Droogte verlamt cruciale Duitse waterwegen
Droogte verlamt cruciale Duitse waterwegen
Hoofdlijnen
- Welk werk doet een cellichaam?
- Denk je dat krekels raar zijn? Kijk eens naar superfans, die de insecten opeten, gebruiken in de kunst en zelfs striptease
- Wat zijn de delen van een gewervelde dieren?
- Hoe viraal afgeleide transposons worden gedomesticeerd om nieuwe levensvormen te ontwikkelen
- Van baanbrekend tot baanbrekend:hoe een unieke tomatenmutatie de duurzame landbouw kan transformeren
- Octopussen geven de voorkeur aan bepaalde wapens bij het jagen en passen tactieken aan hun prooi aan
- Vier wetenschappelijke manieren om te zien of je kat van je houdt
- Welk percentage botten in het lichaam bestaat uit het axiale skelet?
- Wat laat mitose organismen toe?
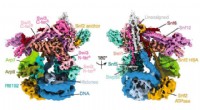
- Onderzoekers brengen de structuur van het sleutelchromatine-remodelleringscomplex in kaart
- De zon vangen:nieuwe dunnefilmtechnologie maakt gebruik van duurzame componenten voor zonnepanelen

- Hoe maak je van plastic afval in je prullenbak winst

- Wetenschappers ontwikkelen een composietmembraan voor op zink gebaseerde stroombatterijen met een lange levensduur

- Een potje poolen in de live cell
 Welke virus infecteren bacteriën?
Welke virus infecteren bacteriën?  Wat is een gemeenschappelijk Devoon -fossiel?
Wat is een gemeenschappelijk Devoon -fossiel?  Hoe wordt energie geproduceerd in de Suns Core?
Hoe wordt energie geproduceerd in de Suns Core?  Waar anders kun je het meioseproces vinden in Lily?
Waar anders kun je het meioseproces vinden in Lily?  De betekenis van emotie:Culturele en biologische evolutie hebben invloed op hoe mensen gevoelens voelen
De betekenis van emotie:Culturele en biologische evolutie hebben invloed op hoe mensen gevoelens voelen  Welke energietransformatie gebeurt wanneer u een doos van de vloer naar schaal tilt?
Welke energietransformatie gebeurt wanneer u een doos van de vloer naar schaal tilt?  De ingrediënten van een kristallen flipper
De ingrediënten van een kristallen flipper Wat betekent 16 F graden in Celsius?
Wat betekent 16 F graden in Celsius?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

