
Wetenschap
Waarom zou het niet altijd mogelijk zijn om de reactanten en producten te bepalen in een reactie in een reactie van uw antwoordtermen van chemisch evenwicht?
Chemisch evenwicht:
* Dynamisch proces: Evenwicht is een dynamische toestand waar de snelheden van de voorwaartse en omgekeerde reacties gelijk zijn. Dit betekent dat zowel de vorming van producten uit reactanten als de vorming van reactanten uit producten tegelijkertijd met dezelfde snelheid optreden.
* constante concentraties: Bij het evenwicht blijven de concentraties van reactanten en producten in de loop van de tijd constant, hoewel de reacties blijven plaatsvinden.
* Geen favoriete richting: Equilibrium betekent niet dat de reactie is "gestopt". Het betekent dat er geen netto verandering is in de concentraties van reactanten en producten omdat de voorwaartse en omgekeerde reacties perfect in evenwicht zijn.
Waarom het moeilijk is om reactanten en producten te labelen:
1. Omkeerbare reacties: De meeste chemische reacties zijn omkeerbaar, wat betekent dat ze in beide richtingen kunnen doorgaan. Bij het evenwicht vinden de voorwaartse en omgekeerde reacties met dezelfde snelheid plaats, dus er is geen duidelijk onderscheid tussen reactanten en producten.
2. Interconversie: Bij het evenwicht zijn reactanten en producten voortdurend met elkaar verbonden. Overweeg bijvoorbeeld de reactie:
`` `
A + B ⇌ C + D
`` `
In evenwicht zal er een mengsel zijn van A, B, C en D, en het is willekeurig om te zeggen dat A en B "reactanten" zijn en C en D "producten" zijn.
3. verschuivende evenwicht: Veranderende omstandigheden (zoals temperatuur, druk of concentratie) kunnen het evenwichtspunt verschuiven, waardoor de voorwaartse of omgekeerde reactie wordt begunstigd. Dit betekent wat aanvankelijk werd beschouwd als een product een reactant zou kunnen worden onder verschillende omstandigheden.
Conclusie:
In een reactie op evenwicht worden de labels "reactanten" en "producten" minder zinvol omdat de reactie dynamisch en omkeerbaar is. Het systeem bestaat in een toestand waar zowel voorwaartse als omgekeerde processen plaatsvinden met gelijke snelheden, wat resulteert in een stabiel mengsel van zowel "reactanten" als "producten".
 Is CH4 covalent of een ionische binding?
Is CH4 covalent of een ionische binding?  Wat is de hardheid van Promethium op MOHS -schaal?
Wat is de hardheid van Promethium op MOHS -schaal?  Wat is de beste analogie voor fasefase?
Wat is de beste analogie voor fasefase?  Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?
Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?  Hoeveel elektronen worden geassocieerd met een enkele covalente binding tussen twee atomen?
Hoeveel elektronen worden geassocieerd met een enkele covalente binding tussen twee atomen?
 Waarom hebben planten zonlicht nodig?
Waarom hebben planten zonlicht nodig?  Stof gezien dat uit Namibië de Atlantische Oceaan instroomt
Stof gezien dat uit Namibië de Atlantische Oceaan instroomt Dieren die zijn gevonden in een tropisch regenwoud
Dieren die zijn gevonden in een tropisch regenwoud  Nieuwe methode om de temperatuur van de ijskap op afstand te meten gedemonstreerd
Nieuwe methode om de temperatuur van de ijskap op afstand te meten gedemonstreerd Marshalleilanden ratificeren als eerste de HFC-broeikasgasovereenkomst
Marshalleilanden ratificeren als eerste de HFC-broeikasgasovereenkomst
Hoofdlijnen
- Het magische staatspark in Californië dat geen bezoekers toestaat
- Wat is een bio -informatiemiddel?
- Wat zijn twee voorbeeld van sekscellen en hoe ze zijn gevormd?
- Kunnen inheemse bijen, nu de kolonies van honingbijen instorten, de bestuiving aan?
- Wat is landbouwbiotechnologie?
- Waar zijn cel -enzymen van gemaakt?
- Vertaling (biologie): definitie, stappen, diagram
- Heeft Linnaeus de wetenschap van DNA -analyse gevonden?
- Coyotes in New York City hoeven niet afhankelijk te zijn van menselijke voeding
- Wetenschappers gebruiken gemodificeerde zijde-eiwitten om nieuwe anti-aanbakoppervlakken te creëren
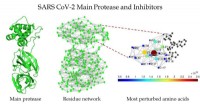
- SARS-CoV-2-enzym aanpakken met remmers
- Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen

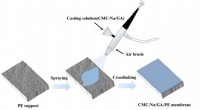
- Pervaporatiemembranen zijn veelbelovend voor de terugwinning van alkalisch afvalwater
- Onderzoekers ontwikkelen met goud gecomplexeerde ferrocenylfosfines als krachtige antimalariamiddelen
 Hoe ver is Mars verwijderd van de aarde en de zon?
Hoe ver is Mars verwijderd van de aarde en de zon?  Wat is de eenheid van snelheid in het SI -systeem?
Wat is de eenheid van snelheid in het SI -systeem?  Oceanografische analyse biedt potentiële crashlocatie van MH370
Oceanografische analyse biedt potentiële crashlocatie van MH370 Plant die 108 jaar geleden uit Vermont verdween, per ongeluk herontdekt, zeggen botanici
Plant die 108 jaar geleden uit Vermont verdween, per ongeluk herontdekt, zeggen botanici  Is het waar dat de lichtste elementen in de vroege aarde naar het centrum van de planeet zijn verplaatst?
Is het waar dat de lichtste elementen in de vroege aarde naar het centrum van de planeet zijn verplaatst?  Wat zijn vormen van conflicten in het landgebruik?
Wat zijn vormen van conflicten in het landgebruik?  Hier is wat je echt ziet als je de Noordpool bezocht
Hier is wat je echt ziet als je de Noordpool bezocht  Hoeveel aarde passen in de superreuzenster?
Hoeveel aarde passen in de superreuzenster?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

