
Wetenschap
Wordt een katalysator gebruikt in reactie?
* Katalysatoren versnellen reacties: Ze bieden een alternatieve reactieroute met een lagere activeringsenergie, waardoor de reactie sneller plaatsvindt.
* Ze blijven ongewijzigd: Katalysatoren worden niet geconsumeerd in de reactie. Ze nemen deel aan het reactiemechanisme, maar worden aan het einde geregenereerd in hun oorspronkelijke vorm.
Denk er zo aan: Stel je een katalysator voor als matchmaker. Ze brengen reactanten samen zodat ze sneller kunnen reageren, maar de matchmaker zelf verandert niet in het proces. Ze kunnen verder gaan met het maken van meer wedstrijden.
Voorbeeld: In de ontleding van waterstofperoxide (H₂o₂) werkt mangaandioxide (MNO₂) als een katalysator. De reactie is:
2h₂o₂ → 2h₂o + o₂
De MNO₂ versnelt de reactie maar wordt niet geconsumeerd. Het kan worden hersteld nadat de reactie is voltooid.
Belangrijke opmerking: Hoewel katalysatoren niet in de reactie worden opgebruikt, kunnen ze worden gedeactiveerd door verschillende factoren zoals vergiftiging (verontreinigingen), veranderingen in temperatuur of druk, of zelfs door de reactieproducten zelf.
 Heeft CO2 de ozonlaag af?
Heeft CO2 de ozonlaag af?  Vluchtelingen uit stijgende zeeën:geen plek om naar huis te bellen
Vluchtelingen uit stijgende zeeën:geen plek om naar huis te bellen In wat voor soort omgeving leeft een jachtluipaard?
In wat voor soort omgeving leeft een jachtluipaard?  Omcirkel de letter van elke factor die wetenschappers gebruiken om verschillende grondsoorten in groepen in te delen a klimaat B Planttype c samenstelling grootte diervervuiling?
Omcirkel de letter van elke factor die wetenschappers gebruiken om verschillende grondsoorten in groepen in te delen a klimaat B Planttype c samenstelling grootte diervervuiling?  Hoe beïnvloeden orkanen het leven van planten?
Hoe beïnvloeden orkanen het leven van planten?
Hoofdlijnen
- Wat gebeurt er met een enzym als de temperatuur te ver van de optimale temperatuur van enzymen varieert?
- Wat is de rol die van vitaal belang is van schimmels zoals Rhizopus in de natuur?
- Onderzoekers vinden mechanisme waarmee plantenwortels zuurstofarme grond vermijden
- Waarom moet een wetenschappelijke hypothese stabiel zijn?
- In de wetenschap verandert het classificatiesysteem van vandaag nog steeds?
- Welke organel is een slijmafscheidende cel die het eiwitproduct afscheidt?
- Wetenschappers ontdekken een schat aan genen die de sleutel kunnen vormen tot de manier waarop mensen evolueerden
- Wat zijn eiwitten ingebed in het plasmamembraan genoemd?
- Hoe snelheid de evolutionaire verandering van de wervelkolom bij zoogdieren beperkt
- Onderzoekssamenwerking kan spuitgieten een nieuwe vorm geven

- Onderzoek naar een thermische uitdaging voor MOF's

- Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof

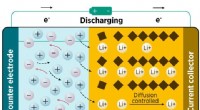
- Röntgenanalyse onthult het oplaadmechanisme van een veelbelovend elektrodemateriaal
- Tegengestelde actie zou de industriële gasscheiding kunnen verbeteren
 Is droog ijs een amorfe vaste stof?
Is droog ijs een amorfe vaste stof?  Hoe vuurwerk werkt
Hoe vuurwerk werkt  Wat is een synoniemen voor het wetenschapswoord meniscus?
Wat is een synoniemen voor het wetenschapswoord meniscus?  Heeft koper een hoge of lage dichtheid?
Heeft koper een hoge of lage dichtheid?  De chemische eigenschappen van calcium lijken het meest op de van?
De chemische eigenschappen van calcium lijken het meest op de van?  Wat Afrikaanse landen uit COP26 hebben gehaald
Wat Afrikaanse landen uit COP26 hebben gehaald Waarom wordt evolutie als theorie overgebracht?
Waarom wordt evolutie als theorie overgebracht?  Antarctica-toerisme:de zoektocht naar de kwetsbare uitersten van de aarde
Antarctica-toerisme:de zoektocht naar de kwetsbare uitersten van de aarde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

