
Wetenschap
Hoe hebben Mendeleev en Moseley de chemische fysische eigenschappen van elementen gebruikt om te helpen bij het regelen van een periodieke tafel?
Mendeleev's aanpak:chemische eigenschappen
* Mendeleev's periodieke wet: Mendeleev concentreerde zich op de chemische eigenschappen van elementen. Hij regelde ze in volgorde van toenemend atoomgewicht, maar cruciaal keek hij ook naar hoe ze reageerden met andere elementen en gevormde verbindingen.
* terugkerende patronen: Hij merkte op dat elementen met vergelijkbare chemische eigenschappen regelmatig in zijn tabel verschenen. De alkali -metalen (Li, Na, K) reageren bijvoorbeeld allemaal krachtig met water en vormen vergelijkbare verbindingen.
* hiaten en voorspellingen: Mendeleev liet gaten in zijn tafel achter voor elementen die nog moesten worden ontdekt. Hij voorspelde zelfs de eigenschappen van deze onontdekte elementen op basis van de eigenschappen van elementen rond de gaten. Dit was een gedurfde zet die de voorspellende kracht van zijn systeem bewees.
Beperkingen van de tabel van Mendeleev:
* Atomaire gewicht anomalieën: In sommige gevallen was de volgorde van elementen op basis van atoomgewicht niet perfect in lijn met hun chemische eigenschappen.
* Geen uitleg voor periodiciteit: De tabel van Mendeleev was gebaseerd op empirische observaties en gaf geen fundamentele verklaring waarom elementen zich gedroegen zoals ze deden.
Moseley's aanpak:fysieke eigenschappen
* X-ray spectroscopie: Moseley gebruikte een nieuwe technologie genaamd röntgenspectroscopie. Hij bombardeerde elementen met elektronen en observeerde de röntgenfoto's die werden uitgestoten. De röntgengolflengten waren uniek voor elk element.
* Atomisch nummer: Moseley besefte dat de röntgengolflengten direct gerelateerd waren aan het aantal protonen in de kern van een element, dat hij het atoomnummer noemde.
* Een meer accurate bestelling: Het werk van Moseley toonde aan dat het atoomnummer, niet atomair gewicht, de fundamentele basis was voor het periodiek systeem. Dit corrigeerde enkele afwijkingen in de tafel van Mendeleev en bood een dieper inzicht in de onderliggende structuur van atomen.
Moseley's bijdragen:
* Een meer accurate periodieke tabel: Het werk van Moseley leidde tot een meer accurate opstelling van elementen, met het atoomnummer als het primaire organisatieprincipe.
* Verklaring voor periodiciteit: Moseley's ontdekking van het atoomnummer bood een wetenschappelijke basis voor de periodiciteit van elementen. Het werd duidelijk dat het chemische gedrag van elementen werd bepaald door het aantal protonen in hun kern.
Samenvattend:
* Mendeleev gebruikte chemische eigenschappen om de eerste periodieke tabel te maken, gericht op terugkerende patronen in reacties en samengestelde vorming.
* Moseley gebruikte fysieke eigenschappen, met name röntgenspectroscopie, om het atoomnummer vast te stellen als het fundamentele organisatieprincipe voor het periodiek systeem.
Zowel Mendeleev als Moseley hebben belangrijke bijdragen geleverd aan ons begrip van de elementen en hun organisatie in het periodieke tabel.
 Directe synthese van isoparaffinerijke benzine uit syngas
Directe synthese van isoparaffinerijke benzine uit syngas Wanneer atomen eindigen met acht of nul valentie -elektronen, hoe zijn ze anders dan eerder?
Wanneer atomen eindigen met acht of nul valentie -elektronen, hoe zijn ze anders dan eerder?  Hoeveel gram o2 is er nodig om 96,6 c3h8 volledig te verbranden?
Hoeveel gram o2 is er nodig om 96,6 c3h8 volledig te verbranden?  Hydrogel-ondersteund microfluïdisch spinnen van rekbare vezels via vloeiende en grensvlak-zelfaanpassing
Hydrogel-ondersteund microfluïdisch spinnen van rekbare vezels via vloeiende en grensvlak-zelfaanpassing  Chemische stoffen gebruikt in de forensische wetenschap
Chemische stoffen gebruikt in de forensische wetenschap
Forensische wetenschap gebruikt technologie en chemie om bewijsmateriaal over misdaden te verzamelen en te analyseren. Het veld bevat taken zoals het verzamelen van vingerafdrukken of het test
 Gematigde Woodland & Shrubland Flowers
Gematigde Woodland & Shrubland Flowers  NASA ziet tropische cycloon 18p ontstaan in de buurt van Amerikaans Samoa
NASA ziet tropische cycloon 18p ontstaan in de buurt van Amerikaans Samoa De toekomst van de aarde wordt geschreven in het snel smeltende Groenland
De toekomst van de aarde wordt geschreven in het snel smeltende Groenland Grond- en satellietobservaties brengen schade aan gebouwen in kaart na de explosie in Beiroet
Grond- en satellietobservaties brengen schade aan gebouwen in kaart na de explosie in Beiroet Wikipedia 'edit wars' toont de dynamiek van het ontstaan en oplossen van conflicten
Wikipedia 'edit wars' toont de dynamiek van het ontstaan en oplossen van conflicten
Hoofdlijnen
- Wat legt wetenschappelijke theorieën uit?
- De taal van cellulaire communicatie begrijpen
- Organismen die zijn verdeeld in klassen die worden genoemd?
- Welke organel wordt aangetroffen in bloedcellen, geen menselijke cellen?
- Wat is een gespecialiseerde cellen die door schimmels en varens worden gebruikt voor reproductie?
- Wat wordt uit RNA -moleculen uitgesneden?
- Wat gebeurt er tijdens de G1-fase?
- De wortels van biodiversiteit:hoe eiwitten verschillen tussen soorten
- Wat is het verschil tussen dominante allelen en recessieve allelen?
- Nieuwe krachtige analogen van plantenhormoon zorgen voor verlichting van droogtestress voor gewassen
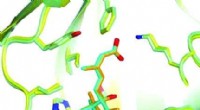
- Corrosiebestendigheid van stalen staven in beton bij vermenging met aerobe micro-organismen
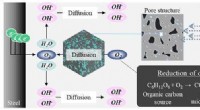
- Moleculen bouwen zoals Tinkertoys? Een doorbraakstudie kan de weg effenen
- Kunnen bacteriën sterkere auto's maken, vliegtuigen en bepantsering?
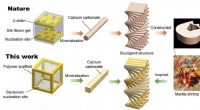
- Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten
 Nieuwe studie onthult communicatiepotentieel van grafeen
Nieuwe studie onthult communicatiepotentieel van grafeen Wat is de oorzaak dat de activaton-energie die nodig is om een chemische reactie te laten plaatsvinden, in het enzym wordt verlaagd?
Wat is de oorzaak dat de activaton-energie die nodig is om een chemische reactie te laten plaatsvinden, in het enzym wordt verlaagd?  De ontbossing in het Amazonegebied en het aantal branden laten zien dat de zomer van 2019 geen ‘normaal’ jaar is
De ontbossing in het Amazonegebied en het aantal branden laten zien dat de zomer van 2019 geen ‘normaal’ jaar is  Economische schade door koolstof is duurder dan gedacht op basis van de huidige wetenschap
Economische schade door koolstof is duurder dan gedacht op basis van de huidige wetenschap Hoe supply chains betrouwbaar te houden wanneer de wereld op zijn kop staat?
Hoe supply chains betrouwbaar te houden wanneer de wereld op zijn kop staat? Welke rol speelt verwering bij de vorming van grond?
Welke rol speelt verwering bij de vorming van grond?  Wat is een stuk steen of metaal dat vrij door de ruimte reist?
Wat is een stuk steen of metaal dat vrij door de ruimte reist?  Eerste catalogus van röntgenbronnen in overlappende waarnemingen gepubliceerd
Eerste catalogus van röntgenbronnen in overlappende waarnemingen gepubliceerd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

