
Wetenschap
Lost oxaalzuur op in zwavelzuur?
* oxaalzuur is een zwak zuur: Het ioniseert niet volledig in water, wat betekent dat het niet al zijn waterstofionen (H+) vrijgeeft.
* zwavelzuur is een sterk zuur: Het ioniseert volledig in water en brengt een aanzienlijke hoeveelheid H+ -ionen uit.
* evenwichtsverschuivingen: Wanneer oxaalzuur wordt toegevoegd aan zwavelzuur, verschuift de sterke zuuromgeving het evenwicht van de oxaalzuur -ionisatie naar de niet -gedisocieerde vorm. Dit "onderdrukt" effectief de ionisatie van oxaalzuur.
De reactie:
De reactie tussen oxaalzuur (H2C2O4) en zwavelzuur (H2SO4) resulteert in de vorming van oxoniumionen (H3O+) en bisulfaationen (HSO4-) samen met niet-gedissocieerd oxaalzuur.
H2C2O4 (aq) + H2SO4 (aq) ⇌ H3O + (aq) + hso4- (aq) + h2c2o4 (aq)
Sleutelpunten:
* De reactie is omkeerbaar , wat betekent dat het oxaalzuur onder bepaalde omstandigheden kan hervormen.
* De aanwezigheid van zwavelzuur vermindert de ionisatie van oxaalzuur.
* De oplossing zal zeer zuur zijn vanwege de aanwezigheid van H3O+ -ionen.
Toepassingen:
Deze reactie wordt gebruikt in verschillende toepassingen, waaronder:
* Analytische chemie: Om de concentratie van oxaalzuur in een oplossing te bepalen.
* organische synthese: Als reagens voor de bereiding van verschillende organische verbindingen.
* schoonmaken: Oxaalzuur, in combinatie met zwavelzuur, wordt gebruikt om roest en andere metaaloxiden te verwijderen.
Veiligheid:
Zowel zwavelzuur als oxaalzuur zijn corrosief. Het is belangrijk om ze met zorg te behandelen en passende veiligheidsuitrusting te dragen. De reactie kan warmte genereren, dus het is cruciaal om het in een goed geventileerd gebied uit te voeren.
 Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen
Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen Wat is het oxidatienummer stikstof voor N2O?
Wat is het oxidatienummer stikstof voor N2O?  Wat is de pH van abrikoos?
Wat is de pH van abrikoos?  Welk type vloeistof gebruik je in een thermometer?
Welk type vloeistof gebruik je in een thermometer?  Video:Er zit goud in zeewater! Kunnen we het extraheren?
Video:Er zit goud in zeewater! Kunnen we het extraheren?
 Een vierkante pen in een rond gat plaatsen - de verrassende structuur van uranium gebonden in hematiet
Een vierkante pen in een rond gat plaatsen - de verrassende structuur van uranium gebonden in hematiet Faseovergangen in olivijn kunnen de oorzaak zijn van diepe seismische breuken
Faseovergangen in olivijn kunnen de oorzaak zijn van diepe seismische breuken Grootse ideeën, wereldwijde nagalm:Grand Canyon op zijn 6 miljoenste verjaardag
Grootse ideeën, wereldwijde nagalm:Grand Canyon op zijn 6 miljoenste verjaardag Belang van een MER in milieubescherming
Belang van een MER in milieubescherming Plasticcrisis – verleg buitenlandse hulp naar stortplaatsen in ontwikkelingslanden
Plasticcrisis – verleg buitenlandse hulp naar stortplaatsen in ontwikkelingslanden
Hoofdlijnen
- De twee soorten exocriene secretoire cellen in de maag
- Hoe veranderen cellen in weefsels?
- Moeder-kind linkerzijde face-to-face voorkeur bleek zich uit te strekken tot walrussen en Indiase vliegende vossen
- Welke positieve effecten hebben mensen op inktvis?
- Waarom zijn poriën in het celmembraan verschillende maten?
- Twee soorten Cilia in een Paramecium
- Verschil tussen gekoppelde en vrijstaande ribosomen
- Wat zijn de eerste vijf dieren op intelligentieschaal?
- Hoe verschillen PLABT en dierencel?
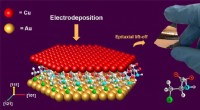
- Onderzoekers gebruiken aminozuren om hoogwaardige dunne koperfilms te laten groeien
- Wetenschappers synthetiseren nieuw nitride en stabiliseren de hexazineringen onder hoge druk
- Weg van plastic:het geval van solid body wash

- Op palladium gebaseerd metaalglas met hoge trombogene weerstand
- Zijn kurkuma-folieverpakkingen de toekomst voor het supermarktschap?

 Kan de NextRadio-app helpen om radio relevant te maken voor een digitaal publiek?
Kan de NextRadio-app helpen om radio relevant te maken voor een digitaal publiek?  Wat studeer je in de biotechnologie?
Wat studeer je in de biotechnologie?  Een diploma belooft een beter leven, maar sociale mobiliteit heeft een keerzijde
Een diploma belooft een beter leven, maar sociale mobiliteit heeft een keerzijde De volgende generatie tools voor big data-analyse maken het streamen van gegevens in realtime inzichtelijk
De volgende generatie tools voor big data-analyse maken het streamen van gegevens in realtime inzichtelijk Welke volgorde toont de vorm van water uit de koudste tot de heetste temperaturen?
Welke volgorde toont de vorm van water uit de koudste tot de heetste temperaturen?  Ballonnen op grote hoogte voor internettoegang in Kenia
Ballonnen op grote hoogte voor internettoegang in Kenia Wat is waar of niet waar, een verbinding heeft dezelfde eigenschappen als de elementen waaruit deze is gevormd?
Wat is waar of niet waar, een verbinding heeft dezelfde eigenschappen als de elementen waaruit deze is gevormd?  Eriochrome Black T Solution Preparation
Eriochrome Black T Solution Preparation
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

