
Wetenschap
Wat is een ionische verbinding gevormd wanneer een halogeen elektron uit metaal wint?
Dit is waarom:
* halogenen zijn zeer elektronegatief, wat betekent dat ze een sterke aantrekkingskracht hebben op elektronen. Ze hebben de neiging om één elektron te krijgen om een stabiele octetconfiguratie in hun buitenste schaal te bereiken.
* metalen zijn elektropositief, wat betekent dat ze de neiging hebben om elektronen te verliezen. Ze verliezen gemakkelijk elektronen om een stabiele configuratie te bereiken, vaak door alle elektronen in hun buitenste schaal te verliezen.
Wanneer een metaal een elektron verliest en een halogeen een elektron krijgt, worden beide atomen ionen. Het metaal vormt een kation (positief geladen ion), terwijl het halogeen een anion vormt (negatief geladen ion). Deze tegengesteld geladen ionen trekken elkaar vervolgens elektrostatisch aan en vormen een ionische binding.
Voorbeeld:
* Natrium (NA) is een metaal in groep 1. Het verliest gemakkelijk één elektron om een natriumion (Na+) te vormen.
* Chloor (CL) is een halogeen in groep 17. Het krijgt gemakkelijk één elektron om een chloride-ion te vormen (Cl-).
Wanneer natrium- en chloor reageren, vormen ze natriumchloride (NaCl) , een gemeenschappelijke ionische verbinding die we kennen als tafelzout.
Algemene formule:
De algemene formule voor ionische verbindingen gevormd tussen een metaal en een halogeen is mx , waar:
* M vertegenwoordigt het metalen kation
* x vertegenwoordigt het halogeenanion
Andere voorbeelden:
* Kaliumbromide (KBR)
* Magnesiumchloride (MGCL2)
* Calciumjodide (CAI2)
* Lithium fluoride (LIF)
 Zijn stikstofoxiden slecht voor het milieu?
Zijn stikstofoxiden slecht voor het milieu?  Heeft Jelly een smeltpunt?
Heeft Jelly een smeltpunt?  Wetenschappers gebruiken eigen cellen en materialen van patiënten om volledig gepersonaliseerde weefselimplantaten van welke aard dan ook te maken
Wetenschappers gebruiken eigen cellen en materialen van patiënten om volledig gepersonaliseerde weefselimplantaten van welke aard dan ook te maken Wat zijn twee manieren waarop de snelheid van een chemische reactie kan worden verhoogd als beide reactanten waterige oplossingen kunnen reactanten?
Wat zijn twee manieren waarop de snelheid van een chemische reactie kan worden verhoogd als beide reactanten waterige oplossingen kunnen reactanten?  Veelgebruikte medicijnbron voor inzichten in de vorming van vlinderkristallen
Veelgebruikte medicijnbron voor inzichten in de vorming van vlinderkristallen
 Onderzoekers onthullen mechanismen voor het reguleren van de temperatuurgevoeligheid van de afbraak van organische stof in de bodem
Onderzoekers onthullen mechanismen voor het reguleren van de temperatuurgevoeligheid van de afbraak van organische stof in de bodem Wat drijft mensen op het gebied van milieu?
Wat drijft mensen op het gebied van milieu?  Massachusetts weegt af met wintertijdverschuiving (update)
Massachusetts weegt af met wintertijdverschuiving (update) Een tijdperk van grote culturele en wetenschappelijke wedergeboorte?
Een tijdperk van grote culturele en wetenschappelijke wedergeboorte?  Siletzia's ontstaan langs een oceanisch verspreidingscentrum:wat heeft Bremerton ermee te maken?
Siletzia's ontstaan langs een oceanisch verspreidingscentrum:wat heeft Bremerton ermee te maken?
Hoofdlijnen
- De vergelijkingen van het leven ontcijferen:een nieuwe theorie beschrijft wat alle dieren gemeen hebben
- Wat kunnen 'ringsoorten' ons leren over evolutie?
- Wat is de vergoeding van natuurlijke hulpbronnen?
- Baanbrekende ontdekking van een geurdetecterende receptorversterker
- Wanneer een object trilt, maakt het een?
- De levenscyclus van een rozenplant
- Welke wetenschapstak wordt de Queen Science genoemd?
- Wetenschappers herscheppen wat misschien wel de eerste vonk van het leven zou kunnen zijn
- Waarom kunnen we de voetstappen van anderen horen,
- Herhalingssleutel tot zelfgenezing, flexibele medische hulpmiddelen

- Verschillen gevonden in antioxidantactiviteiten van astaxanthine-isomeren tegen singletzuurstof
- Anorganische perovskietabsorbers voor gebruik in dunnefilmzonnecellen

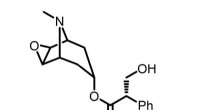
- Onderzoekers melden volledig synthetische route naar scopolamine, middel tegen misselijkheid
- Nieuwe studie stelt lage kosten voor, maskerontwerp met hoog rendement

 Waarom zijn dinosaurusbotten alleen in sedimentaire rots in plaats van stollings rots?
Waarom zijn dinosaurusbotten alleen in sedimentaire rots in plaats van stollings rots?  Met behulp van wiebelend stellair materiaal meten astronomen voor het eerst de spin van een superzwaar zwart gat
Met behulp van wiebelend stellair materiaal meten astronomen voor het eerst de spin van een superzwaar zwart gat  Wat bedrijven niet onthullen over hun CO2-uitstoot
Wat bedrijven niet onthullen over hun CO2-uitstoot  Wat is de afstand van Sedona Arizona tot Grand Canyon?
Wat is de afstand van Sedona Arizona tot Grand Canyon?  Verschillende soorten kompas in het veldonderzoek?
Verschillende soorten kompas in het veldonderzoek?  Elektronica koel houden:bevindingen over gemodificeerde vorm van grafeen kunnen gevolgen hebben bij het beheersen van warmteafvoer
Elektronica koel houden:bevindingen over gemodificeerde vorm van grafeen kunnen gevolgen hebben bij het beheersen van warmteafvoer Ultrasnelle gestimuleerde emissiemicroscopie van enkele nanokristallen
Ultrasnelle gestimuleerde emissiemicroscopie van enkele nanokristallen Het gebruik van H-1B steeg enorm onder techreuzen in de Bay Area
Het gebruik van H-1B steeg enorm onder techreuzen in de Bay Area
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

