
Wetenschap
Waarom corroderen metalen met verschillende snelheden?
1. Samenstelling van het metaal:
* zuiverheid: Onzuiverheden in metalen kunnen microscopische gebieden creëren met verschillende elektrochemische potentialen, waardoor corrosie wordt versneld. Bijvoorbeeld, staal die onzuiverheden bevatten zoals zwavel of fosfor corrodeert sneller dan zuiver ijzer.
* legeringselementen: Het toevoegen van bepaalde elementen om legeringen te vormen kan de corrosieweerstand vergroten of verminderen. Roestvrij staal, met chroom, vormt bijvoorbeeld een beschermende oxidelaag die de corrosie vertraagt.
* Microstructuur: De opstelling van korrels en fasen in een metaal kan de gevoeligheid voor corrosie beïnvloeden.
2. Omgevingscondities:
* Temperatuur: Hogere temperaturen verhogen in het algemeen de snelheid van corrosiereacties.
* Vochtigheid: Vocht bevordert corrosie door een medium te bieden voor elektrochemische reacties.
* Aanwezigheid van elektrolyten: Zouten, zuren en basen in de omgeving versnellen de corrosie door de geleidbaarheid van de elektrolyt te vergroten.
* zuurstof: Zuurstof is een belangrijk onderdeel in veel corrosiereacties, met name in het geval van roest.
* pH: De zuurgraad of alkaliteit van het milieu kan de corrosiesnelheid beïnvloeden.
3. Oppervlakte -eigenschappen:
* Oppervlakteafwerking: Ruwe oppervlakken bieden meer locaties voor corrosie om te initiëren.
* oppervlakte -coatings: Beschermende coatings, zoals verf of plateren, kunnen de corrosiesnelheden aanzienlijk verminderen.
* Stressconcentratie: Gebieden met hoge stress kunnen leiden tot gelokaliseerde corrosie.
4. Elektrochemische factoren:
* Elektrochemische potentiaal: Metalen met meer negatieve elektrochemische potentialen zijn meer vatbaar voor corrosie.
* Polarisatie: De vorming van een beschermende laag op het metaaloppervlak kan de corrosie vertragen, maar deze laag kan worden afgebroken door factoren zoals polarisatie.
Voorbeelden van verschillende corrosiesnelheden:
* goud: Extreem corrosiebestendig vanwege zijn nobele aard en inertie.
* roestvrij staal: Beschikt over corrosie vanwege de vorming van een beschermende oxidelaag.
* ijzer: Vatbaar voor roesten in vochtige omgevingen.
* aluminium: Vormt een beschermende oxidelaag, maar kan vatbaar zijn voor corrosie in bepaalde omgevingen.
Inzicht in de factoren die bijdragen aan corrosie zorgt voor de selectie van geschikte metalen voor specifieke toepassingen, de implementatie van strategieën voor corrosiepreventie en de ontwikkeling van meer corrosiebestendige materialen.
 De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren
De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren Vier voorbeelden van oplossingen die in het dagelijkse leven worden gebruikt die zijn opgeloste stof en oplosmiddel vermelden?
Vier voorbeelden van oplossingen die in het dagelijkse leven worden gebruikt die zijn opgeloste stof en oplosmiddel vermelden?  Een stap dichter bij praktische zonne-waterstofproductie via uitgebreid gemodificeerde hematiet-fotoanode
Een stap dichter bij praktische zonne-waterstofproductie via uitgebreid gemodificeerde hematiet-fotoanode Hoeveel atomen zijn er in aluminium 2H2O?
Hoeveel atomen zijn er in aluminium 2H2O?  Leg de huidige verdeling dunne draad anteen in detail uit?
Leg de huidige verdeling dunne draad anteen in detail uit?
 Er komen meer microplastics in de oceaan door wegwerpmaskers
Er komen meer microplastics in de oceaan door wegwerpmaskers Autopassagiers kunnen het risico op vervuiling verminderen door ramen te sluiten en van route te veranderen
Autopassagiers kunnen het risico op vervuiling verminderen door ramen te sluiten en van route te veranderen Onderzoek naar hoe ver pollen in de atmosfeer reizen, onthult nieuwe inzichten in oorzaken van stedelijke hooikoorts
Onderzoek naar hoe ver pollen in de atmosfeer reizen, onthult nieuwe inzichten in oorzaken van stedelijke hooikoorts Verschillen tussen passagiersduiven en postduiven
Verschillen tussen passagiersduiven en postduiven  Leg uit waarom kritisch denken een belangrijke vaardigheid is in de milieuwetenschappen?
Leg uit waarom kritisch denken een belangrijke vaardigheid is in de milieuwetenschappen?
Hoofdlijnen
- Hoe wordt rijst genetisch gemodificeerd?
- Welke 3 elementen worden gevonden in alle biologische macromoleculen?
- Hoe maken aminozuren eiwitten?
- Hoe een dinosaurus te wegen
- Hoe een ultragevoelige aan-uitschakelaar axolotls helpt ledematen terug te laten groeien
- Hoe zullen chromosomen en genen het gedrag beïnvloeden?
- Deeltjes surfen op hun eigen golven en laten zien hoe microben en cellen door het menselijk lichaam bewegen
- Wanneer is DNA -onderzoek gecreëerd?
- Nieuwe onderzoeksaanpak:onderzoek naar het mondgevoel van voedsel met een microscoop
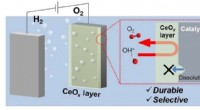
- Zuurstofproductie afschermen om waterstof aan te houden
- Eenden bieden onderzoekers een unieke kans om menselijke aanraking te bestuderen
- Ga de piste op met biobased ski's en snowboards

- Het stabiliseren van emulsieonderzoek verbetert de brandbestrijding en meer

- Een manier om het ontdekken van reacties te versnellen met behulp van automatisering
 Geluidsgolven laten kwantumsystemen met elkaar praten
Geluidsgolven laten kwantumsystemen met elkaar praten Federaal werkloosheidsgeld tijdens pandemie verhoogde uitgaven voor gezondheidszorg
Federaal werkloosheidsgeld tijdens pandemie verhoogde uitgaven voor gezondheidszorg Ontbossing Braziliaanse Amazone bereikt record in april
Ontbossing Braziliaanse Amazone bereikt record in april Stocks en mineralen vormen in reactie op wat?
Stocks en mineralen vormen in reactie op wat?  Zou u stemmen op een Democraat die zich als een Republikein gedraagt?
Zou u stemmen op een Democraat die zich als een Republikein gedraagt? Waarom worden bomen ontworteld tijdens een storm?
Waarom worden bomen ontworteld tijdens een storm?  De ruis in grafeen verlagen
De ruis in grafeen verlagen Hoe de genetische blauwdrukken voor ledematen van vissen kwamen
Hoe de genetische blauwdrukken voor ledematen van vissen kwamen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

