
Wetenschap
Hoe reageert stikstof met HCL?
* Inert Aard van stikstof: Stikstof is een zeer stabiel molecuul vanwege de sterke drievoudige binding tussen zijn atomen. Dit maakt het relatief niet -reactief.
* HCl als zuur: Zuurzuur is een sterk zuur, wat betekent dat het gemakkelijk protonen doneert (H⁺). Het is echter niet sterk genoeg oxidatiemiddel om de sterke drievoudige binding in stikstof te doorbreken.
Samenvattend: Het gebrek aan reactiviteit tussen stikstof en zoutzuur is te wijten aan de sterke drievoudige binding in stikstof en het onvermogen van HCL om te fungeren als een sterk genoeg oxidatiemiddel.
Er zijn echter enkele uitzonderingen:
* Onder zeer specifieke omstandigheden: Stikstof kan reageren met HCL in aanwezigheid van katalysatoren of bij extreem hoge temperaturen en drukken. Deze reacties worden niet vaak aangetroffen.
* Vorming van ammoniumchloride: Hoewel stikstof zelf niet reageert, zal ammoniak (NH₃), die stikstof bevat, reageren met HCl om ammoniumchloride (NH₄CL) te vormen. Deze reactie is een eenvoudige zuurbasisreactie:
NH₃ (G) + HCl (G) → NH₄CL (S)
Vergeet niet dat de algemene regel is dat stikstof erg inert is en niet gemakkelijk reageert met HCL.
 Een zwak magnetisch veld heeft mogelijk de diversificatie van het leven op aarde ondersteund
Een zwak magnetisch veld heeft mogelijk de diversificatie van het leven op aarde ondersteund  Klimaatpatronen gekoppeld in Amazon, Noord- en Zuid-Amerika, studie toont
Klimaatpatronen gekoppeld in Amazon, Noord- en Zuid-Amerika, studie toont Hoe hebben de Haida -stammen met elkaar omgegaan?
Hoe hebben de Haida -stammen met elkaar omgegaan?  Hoe kan recycling helpen vervuiling te voorkomen?
Hoe kan recycling helpen vervuiling te voorkomen?  Hoe smaakte Romeinse wijn? Veel beter dan eerder werd gedacht, zo blijkt uit nieuw onderzoek
Hoe smaakte Romeinse wijn? Veel beter dan eerder werd gedacht, zo blijkt uit nieuw onderzoek
Hoofdlijnen
- Een wetenschapper op televisie stelt dat een hypothese geen toegang kan worden bewezen waarom deze verklaring correct is?
- Wat is een organisme dat afhankelijk is van een ander voor voedsel?
- Wat kan glycolyse stoppen?
- Waarom is seksueel gedrag tussen mensen van hetzelfde geslacht tijdens de evolutie blijven bestaan?
- Welke term verwijst naar organismen die worden gebruikt om de gezondheid van het milieu te bewaken?
- Is een algemeen geaccepteerde verklaring op basis van experimentele resultaten, hoe wordt deze genoemd?
- Is menselijke ontbinding anaëroob of aëroob?
- Waarom was de ontwikkeling van microscoop belangrijk om cellen te ontdekken?
- Wetenschappers identificeren een gen dat kan leiden tot veerkrachtige elfenmaïs
- Onderzoekers verbeteren katalysator die voor altijd chemicaliën vernietigt met zonlicht

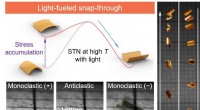
- Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
- Stoere liefde:intense schittering helpt next-gen zonnetechnologie door lastige fase

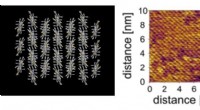
- Celmembraan inspireert nieuwe ultradunne elektronische film
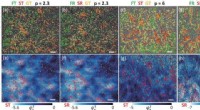
- Wat stopt stromen in glasachtige materialen?
 Nieuwe antibiotica zijn hard nodig - machine learning kan helpen
Nieuwe antibiotica zijn hard nodig - machine learning kan helpen NASA zonnezeil asteroïde missie klaar voor lancering op Artemis I
NASA zonnezeil asteroïde missie klaar voor lancering op Artemis I De tijdloze aantrekkingskracht van een oceaanzwembad:het blijkt een goede investering te zijn, te
De tijdloze aantrekkingskracht van een oceaanzwembad:het blijkt een goede investering te zijn, te Statistici en natuurkundigen werken samen om een machine learning-aanpak te ontwikkelen voor het ontginnen van nucleaire gegevens
Statistici en natuurkundigen werken samen om een machine learning-aanpak te ontwikkelen voor het ontginnen van nucleaire gegevens  Methaanbronnen in Parijs in kaart brengen
Methaanbronnen in Parijs in kaart brengen Nieuw rapport gaat dieper in op drie factoren die bijdragen aan zeespiegelstijging langs de Amerikaanse oostkust
Nieuw rapport gaat dieper in op drie factoren die bijdragen aan zeespiegelstijging langs de Amerikaanse oostkust Beleggers kunnen $ 1 miljard in zelfrijdende auto's van Uber pompen:rapport
Beleggers kunnen $ 1 miljard in zelfrijdende auto's van Uber pompen:rapport Chemische opslag van hernieuwbare energie
Chemische opslag van hernieuwbare energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

