
Wetenschap
Is het waar dat om het totale aantal beschikbare elektronen te vinden voor binding in een positief ion, moet u lading valentie -atomen toevoegen?
Dit is waarom:
* valentie -elektronen zijn de sleutel: Je hebt gelijk in het focussen op valentie -elektronen. Dit zijn de buitenste elektronen en zij zijn degenen die betrokken zijn bij chemische binding.
* Positieve ionen verliezen elektronen: Een positief ion wordt gevormd wanneer een atoom * een of meer elektronen verliest.
* De lading vertelt u hoeveel elektronen verloren gaan: De lading van het positieve ion geeft direct het aantal verloren elektronen aan. Een +2 lading betekent bijvoorbeeld dat het atoom 2 elektronen heeft verloren.
Om het aantal beschikbare elektronen te vinden voor binding in een positief ion, moet u daarom:
1. Bepaal het aantal valentie -elektronen in het neutrale atoom.
2. Trek het aantal verloren elektronen af, dat gelijk is aan de grootte van de positieve lading.
Voorbeeld:
Laten we het voorbeeld nemen van een magnesiumion (mg²⁺):
1. Magnesium (mg) heeft 2 valentie -elektronen.
2. Mg²⁺ heeft een +2 lading, wat betekent dat het 2 elektronen heeft verloren.
3. Daarom heeft mg²⁺ 0 Valentie -elektronen beschikbaar voor binding.
Belangrijke opmerking: Hoewel een positief ion minder valentie -elektronen heeft dan zijn neutrale atoom, is het nog steeds in staat om bindingen te vormen. Dit komt omdat het ionische bindingen kan vormen door negatief geladen ionen aan te trekken.
Samenvattend wordt het aantal beschikbare elektronen voor binding in een positief ion gevonden door de grootte van de positieve lading af te trekken van het aantal valentie -elektronen in het neutrale atoom.
 NASA identificeert nieuwe Atlantische tropische storm Sebastien
NASA identificeert nieuwe Atlantische tropische storm Sebastien Wat is de enige natuurlijke structuur die uit de ruimte wordt gezien?
Wat is de enige natuurlijke structuur die uit de ruimte wordt gezien?  Kunnen dieren het weer voorspellen?
Kunnen dieren het weer voorspellen?  Hoe klimaatverandering zeepijpen op Antarctica beïnvloedt
Hoe klimaatverandering zeepijpen op Antarctica beïnvloedt Vijf miljard zouden in 2050 moeite hebben om toegang te krijgen tot water:UN
Vijf miljard zouden in 2050 moeite hebben om toegang te krijgen tot water:UN
Hoofdlijnen
- Waar worden mesenchymale stamcellen voor gebruikt?
- Leg 2 manieren uit waarop technologie wordt gebruikt op het gebied van genetica?
- Moderne plantaardige enzymen werken samen met verrassend oude eiwitten
- Wat zijn de beperkingen van wetenschappelijke modellen?
- Zijn laboratoriumratten echt vatbaar voor kanker?
- Wat is fosfoglyceraldehyde?
- Beschrijf meiose 1 en 2?
- Het opzetten van een genoombrede kaart van bacteriële genen die cruciaal zijn voor de kolonisatie van planten door nuttige microben
- Wat zou er gebeuren als de micro -organismen uit de voedselketen werden verwijderd?
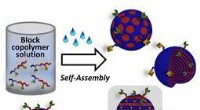
- Creatie en selectieve functionalisering van virusachtige polymeerdeeltjes
- Onderzoeker gebruikt canola om biologisch afbreekbare huishoudfolie te maken

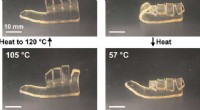
- Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
- Een elektrisch geladen glazen display wisselt soepel tussen een spectrum van kleuren

- Chemische binding versus elektromagnetische golven

 Nieuwe video's tonen RNA zoals het nog nooit is gezien
Nieuwe video's tonen RNA zoals het nog nooit is gezien  Wat is het veranderen van een vloeistof in een gas aan de oppervlaktevloeistof?
Wat is het veranderen van een vloeistof in een gas aan de oppervlaktevloeistof?  Hoe heet is Mars aan de oppervlakte?
Hoe heet is Mars aan de oppervlakte?  Onderzoek naar matchmaking van koraal en algen op cellulair niveau
Onderzoek naar matchmaking van koraal en algen op cellulair niveau Waarom wordt siliconenolie gebruikt in smeltpuntapparatuur?
Waarom wordt siliconenolie gebruikt in smeltpuntapparatuur?  Een incubator laten groeien Bacteriën
Een incubator laten groeien Bacteriën Wanneer kwam Galileo met zijn theorie aarde spins en banen ook de zon?
Wanneer kwam Galileo met zijn theorie aarde spins en banen ook de zon?  Gezondheidsbesparingen wegen zwaarder dan de kosten van het beperken van de opwarming van de aarde:studie
Gezondheidsbesparingen wegen zwaarder dan de kosten van het beperken van de opwarming van de aarde:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

