
Wetenschap
Hoe verschilt de concentratie van water in oplossing?
1. Puur water:
* Hoogste concentratie: Zuiver water heeft de hoogste concentratie watermoleculen, omdat het alleen water bevat.
* molariteit: De molariteit van zuiver water is ongeveer 55,5 m (mol per liter).
2. Oplossingen:
* Lagere concentratie: Wanneer een opgeloste stof (zoals zout, suiker of een chemische stof) wordt opgelost in water, neemt de concentratie van watermoleculen af.
* verdunning: Hoe meer opgeloste stof wordt toegevoegd, hoe meer verdund het water wordt.
* concentratie hangt af van opgeloste stof: De specifieke waterconcentratie zal variëren, afhankelijk van de hoeveelheid aanwezige opgeloste stof.
* Voorbeeld: Een zoutwateroplossing (NaCl opgelost in water) zal een lagere concentratie watermoleculen hebben dan zuiver water.
Waterconcentratie meten:
Hoewel het niet typerend is om de concentratie van water in oplossingen direct te meten, kunnen we de concentratie ervan afleiden door:
* Molariteit van opgeloste stof: Door de molariteit van de opgeloste stof te kennen, kunnen we de molariteit van water berekenen, rekening houdend met het totale volume van de oplossing.
* Andere eigenschappen meten: Sommige eigenschappen van oplossingen, zoals dampdruk, vriespunt of osmotische druk, worden beïnvloed door de waterconcentratie, waardoor we de concentratie ervan kunnen afleiden.
Sleutelpunt: De concentratie water in een oplossing is omgekeerd evenredig met de concentratie van de opgeloste stof. Hoe meer opgeloste stof aanwezig is, hoe lager de concentratie van watermoleculen.
 inheemse volkeren, bewakers van de natuur, belegerd
inheemse volkeren, bewakers van de natuur, belegerd Een mariene microbe zou een steeds belangrijkere rol kunnen spelen bij het reguleren van het klimaat
Een mariene microbe zou een steeds belangrijkere rol kunnen spelen bij het reguleren van het klimaat Is biologisch vlees milieuvriendelijk?
Is biologisch vlees milieuvriendelijk?  Branden in zwaar getroffen staat Australië, maar nu dreigen overstromingen
Branden in zwaar getroffen staat Australië, maar nu dreigen overstromingen Meerderheid van Gen Z weet niet hoe vleesconsumptie het klimaat beïnvloedt
Meerderheid van Gen Z weet niet hoe vleesconsumptie het klimaat beïnvloedt
Hoofdlijnen
- Wat bepaalt de eigenschappen van een organisme in DNA?
- Wat is een biofilm?
- Welke voordelen heeft een complex organisme?
- Muggen gebruiken darmbacteriën om de malaria die ze overbrengen te bestrijden. Wetenschappers onderzoeken hoe dit komt
- Wat zijn pollen en zaden geëvolueerd als reactie op?
- In gymnospermen komen mannelijke kegels meestal op hogere takken en verder van de stam dan vrouwelijk, waarom zou dit zijn?
- Waar gaan vogelseeds uit?
- Welke uitspraken zijn waar voor alle wetenschappelijke inspanningen?
- Heerlijke narcissen zijn super eenvoudig te kweken. Hier is hoe
- Ingenieurs creëren de meest slijtvaste metaallegering ter wereld

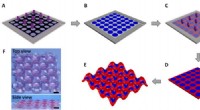
- Hydrogels met periodiek patroon:een model voor coöperatieve vervorming
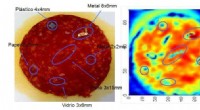
- Sensoren ontwerpen om vreemde lichamen in voedsel te detecteren
- Lasers en vlammen:techniek kan de prestaties van hightech materialen verfijnen

- Onderzoekers gebruiken elektrostatische lading om deeltjes te assembleren tot materialen die edelstenen nabootsen, zout

 Nieuw onderzoek naar speurhonden kan levens redden
Nieuw onderzoek naar speurhonden kan levens redden Is het het beste om gunstige informatie over producten achter te houden?
Is het het beste om gunstige informatie over producten achter te houden?  Tumultueuze melkwegfusies zijn beter in het inschakelen van zwarte gaten
Tumultueuze melkwegfusies zijn beter in het inschakelen van zwarte gaten Hoe wordt energie van de zon naar de aarde gebracht?
Hoe wordt energie van de zon naar de aarde gebracht?  Navigeren door onzekerheid:waarom we beslissingstheorie nodig hebben tijdens een pandemie
Navigeren door onzekerheid:waarom we beslissingstheorie nodig hebben tijdens een pandemie Kleine plastic deeltjes in het milieu
Kleine plastic deeltjes in het milieu Kristaloscillatoren testen
Kristaloscillatoren testen Een nadere blik op de rook van bosbranden levert nieuwe aanwijzingen op over luchtvervuiling
Een nadere blik op de rook van bosbranden levert nieuwe aanwijzingen op over luchtvervuiling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

