
Wetenschap
Waarom verschilt een edelgas van andere elementen?
* Volledige valentie -shell: Nobele gassen hebben een volledige buitenste elektronenschil, ook bekend als de valentieschaal. Dit betekent dat ze het maximale aantal elektronen hebben dat hun energieniveaus kunnen bevatten.
* inertie: De volledige valentie -schaal maakt nobele gassen extreem stabiel en niet -reactief. Ze winnen niet gemakkelijk of verliezen ze elektronen om chemische bindingen te vormen. Daarom worden ze vaak 'inerte gassen' genoemd.
* Monoatomisch bestaan: Nobele gassen bestaan als enkele atomen (monoatomisch) in hun natuurlijke toestand. Ze vormen geen moleculen met zichzelf of andere elementen.
* kleurloos, geurloos en smakeloos: De meeste edelgassen zijn kleurloos, geurloos en smakeloos onder normale omstandigheden.
* Lage kookpunten: Nobele gassen hebben zeer lage kookpunten, wat betekent dat ze bestaan als gassen bij kamertemperatuur.
Hier is een vergelijking:
* Andere elementen: De meeste andere elementen hebben gedeeltelijk gevulde valentieschalen, waardoor ze reactief zijn. Ze hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie te bereiken, zoals die van edelgassen.
* Nobele gassen: Hun volledige valentieschelpen maken ze stabiel en niet -reactief. Ze hoeven geen banden te vormen met andere elementen.
Samenvattend: De unieke elektronenconfiguratie van Noble Gassen met een volledige valentie -shell onderscheidt ze, waardoor ze uitzonderlijk stabiel en niet -reactief zijn in vergelijking met andere elementen.
 Wat wordt gevormd als de waterdamp afkoelt?
Wat wordt gevormd als de waterdamp afkoelt?  Wat gebeurt er met de dichtheid van de meeste vloeistoffen als ze worden verwarmd?
Wat gebeurt er met de dichtheid van de meeste vloeistoffen als ze worden verwarmd?  Hoeveel gram koolstofdioxide wordt geproduceerd wanneer 23,5 g 1-heptanol reageert met overtollige zuurstof in een verbrandingsreactie?
Hoeveel gram koolstofdioxide wordt geproduceerd wanneer 23,5 g 1-heptanol reageert met overtollige zuurstof in een verbrandingsreactie?  Onderzoekers hebben bewezen dat ozon effectief is bij het desinfecteren van coronavirus
Onderzoekers hebben bewezen dat ozon effectief is bij het desinfecteren van coronavirus Een neutraal atoom heeft hetzelfde aantal protonen als neutronen?
Een neutraal atoom heeft hetzelfde aantal protonen als neutronen?
 Grassland Biome gevaren
Grassland Biome gevaren  NASA ziet vorming van tropische depressie Two-E in de oostelijke Stille Oceaan
NASA ziet vorming van tropische depressie Two-E in de oostelijke Stille Oceaan Explosieve uitbarsting doet vulkaan op Caribbeans St. Vincent
Explosieve uitbarsting doet vulkaan op Caribbeans St. Vincent NASA vindt tropische storm Rene minder last van windschering
NASA vindt tropische storm Rene minder last van windschering Canadese ijskappen verdwijnen, bevestiging van de wetenschappelijke voorspelling van 2017
Canadese ijskappen verdwijnen, bevestiging van de wetenschappelijke voorspelling van 2017
Hoofdlijnen
- NOAA rapporteert een aanhoudende daling van de overbevissing
- Is een perzikboom bloeiende of kegeldragende plant?
- Welke woorden kunt u gebruiken om een hypothese te vormen?
- Welke soorten genen worden getranscribeerd maar niet vertaald?
- Een wetenschappelijke verklaring die nooit kan worden gewijzigd, is een wetenschappelijk?
- De wilde ezel keert terug
- Wat is de belangrijkste organel in een cel en waarom?
- De bloemenklok:hoe een klein eiwit bloemen helpt zich goed en op tijd te ontwikkelen
- Wat is divergentie in de evolutie?
- Onderzoekers ontdekken een verband tussen twee belangrijke producten van stikstofmonoxide

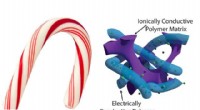
- Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken
- Robuuste vaste katalysator zorgt voor hoge opbrengsten aan esters door continue stroom

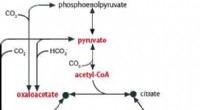
- Ontdekking van een oermetabolisch systeem dat ons een glimp geeft van de oorsprong van het leven op aarde
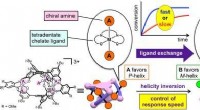
- Chiraliteitsinversie in een spiraalvormig molecuul bij gecontroleerde snelheden
 Planten van de tropische savanne
Planten van de tropische savanne  Hoe beweegt water door en omgeving?
Hoe beweegt water door en omgeving?  Welk micoorganisme wordt verspreid door de release van sporen?
Welk micoorganisme wordt verspreid door de release van sporen?  Zullen we binnenkort uitgestorven zijn?
Zullen we binnenkort uitgestorven zijn?  Ja, meer koolstofdioxide in de atmosfeer helpt planten groeien, maar het is geen excuus om klimaatverandering te bagatelliseren
Ja, meer koolstofdioxide in de atmosfeer helpt planten groeien, maar het is geen excuus om klimaatverandering te bagatelliseren Natuurlijke bronnen van water
Natuurlijke bronnen van water  Wat is de hersenschoenen van fysiek?
Wat is de hersenschoenen van fysiek?  Viseieren stikken in de riffen van Lake Michigan. Wat is er nodig om deze kwekerijen te redden?
Viseieren stikken in de riffen van Lake Michigan. Wat is er nodig om deze kwekerijen te redden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

