
Wetenschap
Wat is de verklaring van een atoom of ionen iso -elektronisch met een edelgasgemiddelde?
Hier is een uitsplitsing:
* nobele gassen Zijn de elementen in groep 18 van de periodieke tabel (HE, NE, AR, KR, XE, RN). Ze staan bekend om hun stabiliteit en gebrek aan reactiviteit door een volledige buitenste schaal van elektronen.
* Elektronenconfiguratie Beschrijft de opstelling van elektronen in de orbitalen van een atoom.
* iso -elektronisch betekent hetzelfde aantal elektronen hebben.
Hoe gebeurt dit?
Atomen kunnen elektronen verkrijgen of verliezen om een stabiele, edelgasconfiguratie te bereiken. Dit proces staat bekend als ionisatie , en het kan ionen creëren (geladen atomen).
Voorbeelden:
* natrium (na) Heeft één elektron in zijn buitenste schaal. Door dat elektron te verliezen, wordt het een natriumion (Na+) met dezelfde elektronenconfiguratie als neon (ne) . Daarom is Na+ iso -elektronisch met NE.
* chloor (Cl) heeft zeven elektronen in zijn buitenste schaal. Door één elektron te winnen, wordt het een chloride-ion (Cl-) met dezelfde elektronenconfiguratie als argon (AR) . Daarom is cl- iso-elektronisch met AR.
Sleutelpunten:
* ISO -elektronische soorten hebben hetzelfde aantal elektronen en dezelfde elektronenconfiguratie.
* Atomen of ionen die iso -elektronisch zijn met edelgassen zijn meestal stabieler.
* Dit concept is belangrijk voor het begrijpen van chemische binding en de reactiviteit van elementen.
Door het concept van iso -elektronische soorten te begrijpen, kunnen we beter voorspellen hoe atomen zullen interageren en verbindingen vormen.
 Wat is een wetenschapper die elementen van elementen en moleculen bestudeert?
Wat is een wetenschapper die elementen van elementen en moleculen bestudeert?  Neutrale atomen van neon atoomnummer 10 hebben dezelfde elektronen als elk wat behalve?
Neutrale atomen van neon atoomnummer 10 hebben dezelfde elektronen als elk wat behalve?  Hoe een indicator te lezen Kleurenoverzicht
Hoe een indicator te lezen Kleurenoverzicht Onderzoekers ontwikkelen een op amfibieën geïnspireerde camouflagehuid
Onderzoekers ontwikkelen een op amfibieën geïnspireerde camouflagehuid  Hoe ratelslangenschubben hen helpen regenwater uit hun lichaam te zuigen
Hoe ratelslangenschubben hen helpen regenwater uit hun lichaam te zuigen
 Waarom de Europese kolonisatie de blauwe antilope met uitsterven bedreigde
Waarom de Europese kolonisatie de blauwe antilope met uitsterven bedreigde  Verborgen geheimen in steen geschreven:Hallett Cove decoderen met virtual reality
Verborgen geheimen in steen geschreven:Hallett Cove decoderen met virtual reality Leeftijden van het Navajo-zandsteen
Leeftijden van het Navajo-zandsteen NASA vindt overblijfselen van Nisargas boven Centraal-India
NASA vindt overblijfselen van Nisargas boven Centraal-India Welke methode gebruiken ze om het interieur van de aarde te bestuderen?
Welke methode gebruiken ze om het interieur van de aarde te bestuderen?
Hoofdlijnen
- Hoe classificeren wetenschappers planten?
- Wat is de naam van het proces wanneer zuurstof cellen verplaatst?
- Wat is het doel van hybridisatie?
- Gestrande walvisachtigen? Daar is een app voor
- Overeenkomsten van mitose en meiose
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Staan we op een kantelpunt met onkruidbestrijding?
- Hoe transporteren dragereiwitten ADP en ATP de mitochondriën in?
- Hoe cellen beslissen op welke manier ze hun inhoud willen recyclen
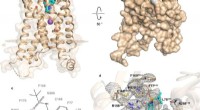
- Studie onthult structuur van receptor die betrokken is bij diabetes type 2 en meer
- Nieuwe carrier-doping in p-type halfgeleiders verbetert de prestaties van fotovoltaïsche apparaten door de gatenconcentratie te verhogen

- Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief

- Uit onderzoek blijkt dat elk haar van het menselijk lichaam kan worden gebruikt voor identificatie

- Ingenieurs demonstreren supersterk, omkeerbare lijm die werkt als slakkenslijm (update)

 Moleculaire orbitale theorie is gebaseerd op welk model van het atoom?
Moleculaire orbitale theorie is gebaseerd op welk model van het atoom?  Heeft een veelvoorkomende kinderziekte de Neanderthalers ten val gebracht?
Heeft een veelvoorkomende kinderziekte de Neanderthalers ten val gebracht? Seks werk, onderdeel van de online kluseconomie, is een reddingslijn voor gemarginaliseerde werknemers
Seks werk, onderdeel van de online kluseconomie, is een reddingslijn voor gemarginaliseerde werknemers Hollywoods eerste blockchain-film:een einde aan piraterij?
Hollywoods eerste blockchain-film:een einde aan piraterij? Emiraten bereikt als eerste Arabier ISS
Emiraten bereikt als eerste Arabier ISS Wat zijn de juiste hemelvaart en declinatie van Star Procyon?
Wat zijn de juiste hemelvaart en declinatie van Star Procyon?  Hoe de som en productwaarschijnlijkheidsregels uit te leggen
Hoe de som en productwaarschijnlijkheidsregels uit te leggen  Waarom keren spitssnuitdolfijnen ondanks frequente verstoringen terug naar het sonarbereik van de marine?
Waarom keren spitssnuitdolfijnen ondanks frequente verstoringen terug naar het sonarbereik van de marine?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

