
Wetenschap
Atomic koolstof bevat hoeveel ongepaarde elektronen volgens regel?
1. Elektronenconfiguratie:
* Koolstof heeft een atoomnummer van 6, wat betekent dat het 6 elektronen heeft.
* De elektronenconfiguratie van koolstof is 1s² 2s² 2p².
2. De regel van Hund:
* De heerschappij van Hund stelt dat elektronen elk orbitaal binnen een subshell individueel zullen bezetten voordat ze in een orbitaal verdubbelen.
3. De regel van Hund toepassen:
* De 2P -subshell heeft drie orbitalen (2px, 2py, 2pz).
* Koolstof heeft twee elektronen in de 2P -subshell.
* Volgens de heerschappij van Hund zullen deze twee elektronen afzonderlijke 2p orbitalen bezetten, waardoor één 2p orbitaal leeg blijft.
4. Ongepaarde elektronen:
* Aangezien één 2p orbitaal leeg blijft, heeft atomaire koolstof twee ongepaarde elektronen .
Daarom heeft atomaire koolstof twee ongepaarde elektronen.
 Hoeveel mol zit er in 5,60 L Cl2 bij STP?
Hoeveel mol zit er in 5,60 L Cl2 bij STP?  Hoe vind je de molaire massa van berylliumoxide?
Hoe vind je de molaire massa van berylliumoxide?  Welke stof heeft de laagste pH (0)?
Welke stof heeft de laagste pH (0)?  Welke van de volgende verbindingen is een voorbeeld van een organische verbinding C6H12O6 NO2 H2O O2?
Welke van de volgende verbindingen is een voorbeeld van een organische verbinding C6H12O6 NO2 H2O O2?  Wat heeft oververzadigde oplossing van suikerwater te maken met de wetenschap?
Wat heeft oververzadigde oplossing van suikerwater te maken met de wetenschap?
 Nieuwe studie beantwoordt oude vragen over waarom tropische bossen zo ecologisch divers zijn
Nieuwe studie beantwoordt oude vragen over waarom tropische bossen zo ecologisch divers zijn  Stervende bomen in steden? Geef het de schuld aan het beton
Stervende bomen in steden? Geef het de schuld aan het beton Opsporen van subglaciale wateropslag
Opsporen van subglaciale wateropslag Verander uw dieet om zowel water als uw gezondheid te besparen
Verander uw dieet om zowel water als uw gezondheid te besparen Terwijl 2 stormen de Golfkust bedreigen, bewoners zetten zich schrap voor zondvloed
Terwijl 2 stormen de Golfkust bedreigen, bewoners zetten zich schrap voor zondvloed
Hoofdlijnen
- Welke plant produceert het kleinste zaadje?
- Hoe gaan voedingsstoffen en passeren in een cel?
- Leg de componenten van DNA uit en leg de functionele relatie met RNA -eiwit uit?
- Microbioomstudies helpen bij het onderzoeken van behandelingen voor genetische aandoeningen
- Zijn tijdens de duplicatie van DNA in welk deel cel nieuwe strengen gesynthetiseerd uit een voedingsnucleotiden?
- Hoe lang duurt het voordat zwarte schimmel je doodt?
- Raad eens wie? Gezichten van chimpansees onthullen familierelaties
- Mediterrane wijnmakerijen bevinden zich in een klimaathotspot. Klimatologen helpen hen zich aan te passen
- Wat is de studie van genomen met of tussen soorten?
- Sterk en kneedbaar Damascus-staal door additieve fabricage

- Enzymbiofabrieken om navelstrengbloedtransplantaties te verbeteren

- Vloeibaar water is meer dan alleen waterstof-zuurstofmoleculen
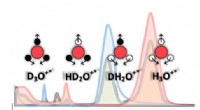
- Formaatdehydrogenase reduceert koolstofdioxide tot mierenzuur
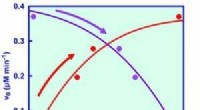
- Microporeuze polymeermembranen voor licht-gated ionentransport
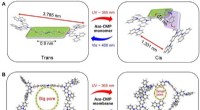
 Waarom wordt de zon als bron van bijna alle energie op aarde beschouwd?
Waarom wordt de zon als bron van bijna alle energie op aarde beschouwd?  Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar
Maritiem continent verzwakt Aziatische tropische moessonregen door Australische stromen over de evenaar Hoe bereken ik de hoeveelheid zuur om de water-pH te verlagen?
Hoe bereken ik de hoeveelheid zuur om de water-pH te verlagen?  Geavanceerde experimentele opzet breidt de jacht op verborgen donkere materiedeeltjes uit
Geavanceerde experimentele opzet breidt de jacht op verborgen donkere materiedeeltjes uit  Relatie tussen ademhaling en stofwisseling
Relatie tussen ademhaling en stofwisseling Welke planten verliezen hun bladeren in de herfst?
Welke planten verliezen hun bladeren in de herfst?  Urethane versus polyurethaan
Urethane versus polyurethaan  Hoeveel moleculen zijn er aanwezig in 1 molaire massa zwavelzuur?
Hoeveel moleculen zijn er aanwezig in 1 molaire massa zwavelzuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

