
Wetenschap
Wat is het volume van 19,87 mol ammoniumchloride (NH4CL) bij STP?
* STP (standaardtemperatuur en druk): STP wordt gedefinieerd voor gassen, meestal bij 0 ° C (273,15 K) en 1 atm druk.
* ammoniumchloride: Ammoniumchloride is een vaste stof bij STP. Vaste stoffen hebben een vast volume en vorm, in tegenstelling tot gassen die uitzetten om hun container te vullen.
Wat u kunt berekenen:
* Molaire massa van NH4CL: U kunt de molaire massa van ammoniumchloride berekenen, dat ongeveer 53,49 g/mol is.
* Massa van 19.87 Mol NH4Cl: U kunt de massa van 19.87 mol NH4Cl vinden door de mol te vermenigvuldigen met de molmassa:19.87 mol * 53,49 g/mol =1063,7 g
Om het volume van solide NH4CL te bepalen, zou u de dichtheid nodig hebben.
Dit is de reden waarom dichtheid belangrijk is:
* Dichtheid (ρ): Dichtheid is massa per volume -eenheid (ρ =m/v).
* Volume: U kunt de dichtheidsvergelijking herschikken om op te lossen voor volume:v =m/ρ
Daarom zou u, om het volume van 19.87 mol NH4Cl te berekenen, de dichtheid bij STP moeten kennen.
 Natuurlijke afzettingen van heliumgas kunnen helpen bij de veilige productie van schalie- of steenkoolgas, onderzoek suggereert:
Natuurlijke afzettingen van heliumgas kunnen helpen bij de veilige productie van schalie- of steenkoolgas, onderzoek suggereert: Wat gebeurt er als zeestromingen stoppen?
Wat gebeurt er als zeestromingen stoppen?  Voordelen geo-engineering beperkt voor appelteelt in India
Voordelen geo-engineering beperkt voor appelteelt in India Gaten in ijskap Groenland zijn groter dan eerder werd gedacht studie vondsten
Gaten in ijskap Groenland zijn groter dan eerder werd gedacht studie vondsten Studie biedt parels van wijsheid bij omstreden oesterrestauratie in New York
Studie biedt parels van wijsheid bij omstreden oesterrestauratie in New York
Hoofdlijnen
- Hoe converteert ADP naar ATP?
- Hoe wordt de wetenschappelijke studie van het menselijk ras genoemd?
- Welk type enzym is betrokken bij excisiereparatie?
- Wat is een verband tussen koolhydraten en nucleïnezuren?
- Wie zal roofzuchtige wetenschappelijke tijdschriften op afstand houden nu de blog van Jeffrey Beall verdwenen is?
- Hoe een DNA-model te labelen
- Wat wordt er van verschillende typen weefsels gemaakt?
- Wat is de flagella -positie voor Proteus vulgaris?
- Welke klier in de nek reguleert het metabolisme?
- Een energiezuiniger katalytisch proces om olefinen te produceren

- Bouw van betere biosensoren in de gasfase voor de bestrijding van ziekten
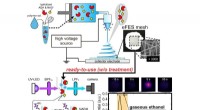
- Een brandstofkatalysator met een hoger rendement

- Kruiskoppelingsreacties:semiheterogene op PCN-Cu gebaseerde metallafotokatalyse
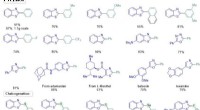
- Biochemici ontdekken hoe reactieve zuurstofsoorten de cisplatineresistentie in eierstokkankercellen beïnvloeden

 Hoe werkt een boiler?
Hoe werkt een boiler?  Hoe verschillen de lysogene en lytische cycli?
Hoe verschillen de lysogene en lytische cycli?  La Nina ontwikkelt zich tijdens piek orkaanseizoen
La Nina ontwikkelt zich tijdens piek orkaanseizoen Bijgewerkte standaardscenario's Outlook-modellen mogelijke futures voor de Amerikaanse elektriciteitssector
Bijgewerkte standaardscenario's Outlook-modellen mogelijke futures voor de Amerikaanse elektriciteitssector Effective Space tekent deal met satellietbedrijf om drones te gebruiken om de levensduur van satellieten in een baan om de aarde te verlengen
Effective Space tekent deal met satellietbedrijf om drones te gebruiken om de levensduur van satellieten in een baan om de aarde te verlengen Berggroei beïnvloedt broeikaseffect
Berggroei beïnvloedt broeikaseffect Hoe droogte zoetwatervissen beïnvloedt
Hoe droogte zoetwatervissen beïnvloedt Waarom sommige uitwerpselen drijven en andere zinken
Waarom sommige uitwerpselen drijven en andere zinken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

