
Wetenschap
Wat is de evenwichtige vergelijking voor het totale aantal gram CO2 dat wordt geproduceerd wanneer 4 C worden toegevoegd aan 10,67 O2?
1. Schrijf de onevenwichtige vergelijking:
C + O₂ → Co₂
2. Breng de vergelijking in evenwicht:
C + O₂ → Co₂ (deze vergelijking is al in balans)
3. Bepaal de beperkende reactant:
* mol C: Stel dat we 4 gram koolstof hebben. De molaire koolstofmassa is 12,01 g/mol.
Mol C =(4 g) / (12,01 g / mol) =0,333 mol
* mol O₂: De molaire massa O₂ is 32,00 g/mol.
Mol o₂ =(10,67 g) / (32,00 g / mol) =0,333 mol
Omdat we gelijke mol beide reactanten hebben, worden ze volledig geconsumeerd en is er geen beperkende reactant.
4. Bereken de mol van de geproduceerde co₂:
Uit de evenwichtige vergelijking zien we dat 1 mol C reageert met 1 mol O₂ om 1 mol co₂ te produceren. Omdat we 0,333 mol beide reactanten hebben, zullen we 0,333 mol produceren van co₂.
5. Bereken de massa geproduceerde co₂:
De molaire massa van CO₂ is 44.01 g/mol.
Massa van co₂ =(0,333 mol) * (44.01 g/mol) = 14,65 g
Daarom worden 14,65 gram co₂ geproduceerd wanneer 4 gram C wordt toegevoegd aan 10,67 gram o₂.
 Vast netwerk van smartphones zorgt voor vroegtijdige aardbevingswaarschuwing in Costa Rica
Vast netwerk van smartphones zorgt voor vroegtijdige aardbevingswaarschuwing in Costa Rica Hoe worden mensen getroffen door overstromingen?
Hoe worden mensen getroffen door overstromingen?  Hoe Australische musea de tentoonstelling van menselijke resten reguleren
Hoe Australische musea de tentoonstelling van menselijke resten reguleren  Is een bos groter dan bos?
Is een bos groter dan bos?  Bijensoorten in Wake County, North Carolina:ontbreken ze of zijn ze gewoon moeilijk te vinden?
Bijensoorten in Wake County, North Carolina:ontbreken ze of zijn ze gewoon moeilijk te vinden?
Hoofdlijnen
- Wat zijn de belangrijkste functies van het reproductieve systeem?
- Stijfheid en viscositeit van cellen blijken te verschillen bij kanker en andere ziekten
- Wat is erpsin -enzym?
- Hoe bouwt een worm keel? De 'orgaanvormingspuzzel' aanpakken
- Human Heart Science Projects
- Wat is een netwerk waarin chromatinevezels plaatsvinden?
- Is een cel heterogeen of homogeen systeem?
- Nieuw mechanisme verduidelijkt hoe cellen migreren
- Beter begrip van cellulair metabolisme met behulp van AI
- Wetenschappers synthetiseren nieuwe kunstmatige moleculen die een celmembraaneiwit nabootsen
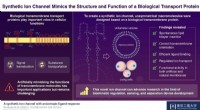
- Nieuwe tools voor het maken van gespiegelde vormen van moleculen

- Een niet-giftig alternatief voor gekleurde rook creëren

- Peulvruchten opgewekt als nieuwe studie geheimen onthult van de plant die mensen kalm houdt

- Groenere waterstof uit water

 Nieuwe horizonten onthult nieuwe kaarten van Pluto, Charon op flyby-jubileum
Nieuwe horizonten onthult nieuwe kaarten van Pluto, Charon op flyby-jubileum Wie crediteert Dr. Tyson eerst dat Pluto niet was opgenomen in zijn museumtentoonstelling?
Wie crediteert Dr. Tyson eerst dat Pluto niet was opgenomen in zijn museumtentoonstelling?  Welke gebieden van korst worden tot een hogere hoogte verhoogd?
Welke gebieden van korst worden tot een hogere hoogte verhoogd?  Mossel verplaatsen:nieuwe inzichten in de schelpdierkweek
Mossel verplaatsen:nieuwe inzichten in de schelpdierkweek Hoe voert een plant fotosynthese uit?
Hoe voert een plant fotosynthese uit?  De middenhersenen van zingende vissen in Californië kunnen als model dienen voor de manier waarop zoogdieren hun stemuitdrukkingen controleren
De middenhersenen van zingende vissen in Californië kunnen als model dienen voor de manier waarop zoogdieren hun stemuitdrukkingen controleren  Chemici analyseren luchtvervuiling
Chemici analyseren luchtvervuiling Hoe alfabetiseringsprogramma's voor volwassenen First Nations-mensen buiten het strafrechtsysteem kunnen houden
Hoe alfabetiseringsprogramma's voor volwassenen First Nations-mensen buiten het strafrechtsysteem kunnen houden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

