
Wetenschap
Wat gebeurt er als u natriumcarbonaat en waterstofsulfaat mengt?
Hier is de evenwichtige chemische vergelijking:
Na₂co₃ + H₂so₄ → Na₂so₄ + Co₂ + H₂o
Verklaring:
* Natriumcarbonaat is een basisverbinding, terwijl waterstofsulfaat is een sterk zuur.
* De reactie is een zuur-base reactie (Neutralisatiereactie).
* De waterstofionen (H⁺) van het zwavelzuur reageren met de carbonaationen (co₃²⁻) van natriumcarbonaat.
* Deze reactie produceert koolstofdioxidegas (Co₂) die eruit bubbelt, en water (H₂o).
* De resterende ionen, natrium (Na⁺) en sulfaat (So₄²⁻), combineren om natriumsulfaat te vormen (Na₂so₄), die in oplossing blijft.
Key Observations:
* borrelen: U zult de afgifte van koolstofdioxidegas als bubbels waarnemen.
* Warmte -generatie: De reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* Verander in pH: De initiële oplossing van zwavelzuur zou zuur zijn, maar na de reactie zal de pH toenemen naarmate het zuur wordt geneutraliseerd.
Veiligheidsmaatregelen:
* zwavelzuur is een corrosief zuur. Draag passende veiligheidsuitrusting, zoals handschoenen en bril, bij het hanteren ervan.
* De reactie genereert warmte, dus ga het mengsel zorgvuldig af.
* Doe de reactie in een goed geventileerd gebied, omdat kooldioxidegas gevaarlijk kan zijn in hoge concentraties.
 Wat we leerden toen onze kaart van de rivieren van zuidelijk Afrika viraal ging
Wat we leerden toen onze kaart van de rivieren van zuidelijk Afrika viraal ging De afvalverzamelende fietsers die de aandacht van de VN trokken
De afvalverzamelende fietsers die de aandacht van de VN trokken Hoe groeit een fruitboom?
Hoe groeit een fruitboom?  Hoe levert de aarde natuurlijke hulpbronnen die de mens in het dagelijks leven gebruikt?
Hoe levert de aarde natuurlijke hulpbronnen die de mens in het dagelijks leven gebruikt?  Ivoorstroperij op kritiek niveau:olifanten op weg naar uitsterven in 2020?
Ivoorstroperij op kritiek niveau:olifanten op weg naar uitsterven in 2020?
Hoofdlijnen
- Welk deel van de plant transporteert water en voedingsstoffen van wortels tot stengelbladeren?
- Wat deed de hypothese in Quicksand?
- Welke soorten bewijs gebruiken wetenschappers om een organisme op een fylogene boom te plaatsen en wat vertelt die plaats je?
- Wat is het lot van buiskern in pollenbuis?
- Waar wordt glycogeen gevonden?
- Ongeveer welk percentage van een genen op elk moment wordt gebruikt a. 1 tot 2 procent b. 5 10 c. 25 50 procent. D. 70 80 e. 90 99 percen?
- Timing van migratie verandert voor zangvogels aan de Pacifische kust
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Wat voert antwoorden op de wetenschap uit?
- Nieuwe experimentele strategie verheldert complexe kristalstructuur
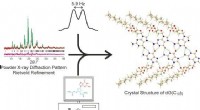
- Door het smelten van een elektronenbundel krijgt bros metaal vorm

- Video:Het Vrijheidsbeeld ware kleuren

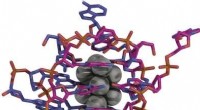
- Bepaling van de kristalstructuur van een DNA-gestabiliseerd zilveren nanocluster
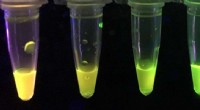
- Chemici ontwikkelen op papier gebaseerde sensor om krachtige zenuwtoxines te detecteren
 Wat is 0,167 in standaardvorm?
Wat is 0,167 in standaardvorm?  Toezichthouders overwegen hoe ze de zuidelijke kreeft uit New England kunnen redden
Toezichthouders overwegen hoe ze de zuidelijke kreeft uit New England kunnen redden  Maak een lijst van californias energiebronnen en beschrijf waar ze zijn gevormd?
Maak een lijst van californias energiebronnen en beschrijf waar ze zijn gevormd?  Niet giftig, hoogwaardige oppervlaktebehandeling voor organische veldeffecttransistoren
Niet giftig, hoogwaardige oppervlaktebehandeling voor organische veldeffecttransistoren Bio-geïnspireerde mineralisatie van calciumcarbonaat in peptide hydrogel
Bio-geïnspireerde mineralisatie van calciumcarbonaat in peptide hydrogel De zuurstof op aarde nam geleidelijk toe in plaats van grote uitbarstingen
De zuurstof op aarde nam geleidelijk toe in plaats van grote uitbarstingen Oplossing voor watertekorten:hergebruik van afvalwater voor irrigatie met grondwater
Oplossing voor watertekorten:hergebruik van afvalwater voor irrigatie met grondwater Helder en efficiënt licht zonder zeldzame metalen
Helder en efficiënt licht zonder zeldzame metalen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

