
Wetenschap
Welke charaecteristieken delen solide ionische verbindingen?
Structuur en binding:
* kristallijne structuur: Ze hebben een zeer geordende, driedimensionale opstelling van ionen die een kristalrooster worden genoemd. Deze opstelling minimaliseert elektrostatische afstoting en maximaliseert de aantrekkingskracht.
* ionische binding: De samenstellende ionen worden bij elkaar gehouden door sterke elektrostatische aantrekkingskrachten tussen tegengesteld geladen ionen. Dit resulteert in een zeer sterke binding.
eigenschappen:
* Hoog smelten- en kookpunten: Vanwege de sterke ionische bindingen is aanzienlijke energie vereist om ze uit elkaar te breken, wat resulteert in hoge smelt- en kookpunten.
* Hard en bros: De stijve kristalstructuur maakt ze hard, maar de geordende opstelling maakt ze bros. Indien geslagen, kunnen de ionen verschuiven, waardoor de elektrostatische balans wordt verstoord en het kristal kan breken.
* Slechte elektriciteitsgeleiders in vaste toestand: De ionen zijn vast in hun posities in het kristalrooster, waardoor de ladingsstroom wordt voorkomen.
* Goede elektriciteitsgeleiders in gesmolten toestand of oplossing: Wanneer gesmolten of opgelost, worden de ionen vrij om te bewegen, waardoor elektrische geleidbaarheid mogelijk is.
* Oplosbaarheid: Veel ionische verbindingen lossen op in polaire oplosmiddelen zoals water, waar de polaire watermoleculen kunnen interageren met en de ionen uit elkaar trekken.
Andere kenmerken:
* Hoge dichtheid: De strak gepakte structuur van het kristalrooster leidt tot hoge dichtheid.
* Typisch transparant of doorzichtig: De opstelling van ionen kan beïnvloeden hoe licht door de verbinding gaat.
Voorbeelden:
* Natriumchloride (NaCl)
* Kaliumbromide (KBR)
* Calciumcarbonaat (CACO3)
* Magnesiumoxide (MGO)
Houd er rekening mee dat er enkele uitzonderingen op deze kenmerken kunnen zijn op basis van de specifieke ionische verbinding en de structuur ervan. De hierboven genoemde eigenschappen zijn echter in het algemeen waar voor de meeste vaste ionische verbindingen.
 Onderzoekers voorspellen materialen om lithium-ionbatterijen met recordhoge capaciteit te stabiliseren
Onderzoekers voorspellen materialen om lithium-ionbatterijen met recordhoge capaciteit te stabiliseren Zelfherstellende composieten verlengen de levensduur van een product
Zelfherstellende composieten verlengen de levensduur van een product Wat is het chemische symbool voor shampoo?
Wat is het chemische symbool voor shampoo?  Gerichte evolutie van een designer-enzym met een onnatuurlijk katalytisch aminozuur
Gerichte evolutie van een designer-enzym met een onnatuurlijk katalytisch aminozuur Wat is de massa in gram van 0,0420 mol koper?
Wat is de massa in gram van 0,0420 mol koper?
 Afbeelding:Zuid-Soedan
Afbeelding:Zuid-Soedan Welk woord betekent hetzelfde manier waarop dingen in de natuur zijn?
Welk woord betekent hetzelfde manier waarop dingen in de natuur zijn?  Transportsystemen hebben te maken met verstoring door extreem weer - beter risicobeheer is nodig
Transportsystemen hebben te maken met verstoring door extreem weer - beter risicobeheer is nodig Duizenden vluchten terwijl een nieuwe tyfoon de Filippijnen bedreigt
Duizenden vluchten terwijl een nieuwe tyfoon de Filippijnen bedreigt Wat betekent het als sommige mannen door het bos gaan en geen brandhout zien?
Wat betekent het als sommige mannen door het bos gaan en geen brandhout zien?
Hoofdlijnen
- Producten vervaardigd door Anaerobe Ademhaling
- Waar codeert een groep van drie nucleotiden voor?
- Big data omzetten in betere rassen en variëteiten:kan AI de planeet helpen voeden?
- Wat is de studie van ethische implicaties Biologisch onderzoek en toepassingen, vooral in veldgeneeskunde?
- Wat is de wetenschappelijke classificatie van Tulsi Tree?
- De wetenschappelijke methode wordt het meest gebruikt in welke van deze sociale wetenschappen?
- Is sommige microorgamisme beter bestand tegen hitte dan anderen?
- Hoe je geur te verbergen voor honden
- Het ontsluiten van de geheimen van hoe cellen communiceren biedt inzichten in de behandeling van ziekten
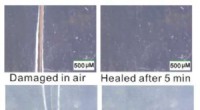
- Wetenschappers ontdekken nieuw type zelfherstellend materiaal
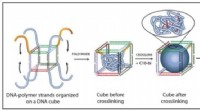
- DNA-strengen gebruiken om nieuwe polymeermaterialen te ontwerpen
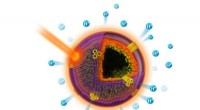
- Energie halen uit licht met behulp van bio-geïnspireerde kunstmatige cellen
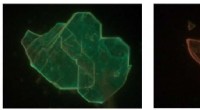
- Kameleonmaterialen:de oorsprong van kleurvariatie in laagdimensionale perovskieten
- Een snelwegtunnel maken voor ionen

 Hoe verhoudt energie van zaklampbatterijen zich tot het licht en warmte geeft af?
Hoe verhoudt energie van zaklampbatterijen zich tot het licht en warmte geeft af?  Hoe is een bruine kluizenaarspin als een samoeraienzwaardsmid?
Hoe is een bruine kluizenaarspin als een samoeraienzwaardsmid? Hoe BRCA-genen werken
Hoe BRCA-genen werken  14 kwantumbits:natuurkundigen overschrijden de grenzen van wat momenteel mogelijk is op het gebied van berekeningen
14 kwantumbits:natuurkundigen overschrijden de grenzen van wat momenteel mogelijk is op het gebied van berekeningen  Is de aarde en de zon dezelfde grootte?
Is de aarde en de zon dezelfde grootte?  Wat is de laag van rots- en minerale fragmenten geproduceerd door verwering die bijna alle aardse oppervlakte van de aarde bedekt?
Wat is de laag van rots- en minerale fragmenten geproduceerd door verwering die bijna alle aardse oppervlakte van de aarde bedekt?  Coronale massa-ejecties en kosmische stralingswaarnemingen op Syowa Station
Coronale massa-ejecties en kosmische stralingswaarnemingen op Syowa Station Wat vinden onderzoeksorganisaties van open access publiceren?
Wat vinden onderzoeksorganisaties van open access publiceren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

