
Wetenschap
Hoe wordt elektrische neutraliteit gehandhaafd in een ionische verbinding?
1. Tegengestelde ladingen trekken aan:
* Ionische verbindingen worden gevormd door de elektrostatische aantrekkingskracht tussen positief geladen ionen (kationen) en negatief geladen ionen (anionen). Zie het als magneten:tegengestelde palen trekken aan!
2. Gelijke en tegengestelde ladingen:
* De sleutel tot neutraliteit is dat de totale positieve lading van de kationen precies gelijk moet zijn aan de totale negatieve lading van de anionen. Dit betekent dat het aantal van elk type ion dat in de verbinding aanwezig is, moet worden aangepast om deze balans te bereiken.
3. Voorbeeld:natriumchloride (NaCl)
* Natrium (NA) verliest één elektron om een +1 kation te worden (Na +).
* Chloor (CL) krijgt één elektron om een -1 anion te worden (Cl-).
* De verhouding van natrium tot chloorionen in de verbinding is 1:1. Dit zorgt ervoor dat de +1 lading van het natriumion exact wordt gebalanceerd door de -1 -lading van het chloorion, resulterend in een neutrale verbinding.
4. Meer complexe verbindingen:
* Voor verbindingen met meer complexe ionen kan de verhouding tussen kationen en anionen anders zijn.
* Bijvoorbeeld, in magnesiumchloride (mgcl2) vormt magnesium (mg) een +2 kation (mg2 +), terwijl chloor (CL) nog steeds een -1 anion vormt (Cl-).
* Om neutraliteit te bereiken, zijn twee chloride-ionen nodig voor elk magnesiumion (Mg2 + + 2Cl- =0).
5. Algemeen:
Het principe van elektrische neutraliteit is een fundamenteel concept in de chemie. Het verklaart waarom ionische verbindingen stabiel zijn en gemakkelijk vormen. De evenwichtige ladingen creëren een sterke elektrostatische aantrekkingskracht die de ionen bij elkaar houdt in een kristalroosterstructuur.
 Vier terug te schalen Amerikaanse monumenten bevatten artefacten, belangrijke habitat
Vier terug te schalen Amerikaanse monumenten bevatten artefacten, belangrijke habitat Kus je bier vaarwel als de klimaatverandering niet wordt aangevinkt
Kus je bier vaarwel als de klimaatverandering niet wordt aangevinkt  BP lanceert $ 28 miljard Azerbeidzjaanse gaspijpleiding
BP lanceert $ 28 miljard Azerbeidzjaanse gaspijpleiding Welke soorten bomen zijn te vinden in Grassland Biomes?
Welke soorten bomen zijn te vinden in Grassland Biomes?  Variatie in boomsoorten resulteert in de schoonste stadslucht
Variatie in boomsoorten resulteert in de schoonste stadslucht
Hoofdlijnen
- Wetenschappers verdelen dieren in twee groepen op basis van het feit of een dier een ruggengraat heeft. Waar onwaar.?
- Wat is een voorbeeld van monosaccaharide glucose sucrose cellulose zetmeel?
- Wat zijn de intermoleculaire krachten van HClO?
- Klop, klop! Wie is daar?
- Squash-variëteit waarvan ooit werd gedacht dat ze uitgestorven was, gedijt goed op biologische boerderij
- Wat vormt een selectief permeabel membraan?
- Naar welke voedselchemicaliën behoort glycogeen?
- Wat is de relatie tussen planten en zuurstof?
- Wat zorgt ervoor dat moleculen van een bepaald eiwit altijd in dezelfde vorm vouwen?
- Wetenschappers vinden lijm uit die wordt geactiveerd door magnetisch veld

- Enzymatische photocaging voor de studie van genregulatie door middel van DNA-methylatie
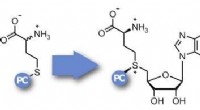
- De baanbrekende techniek van scheikundigen in Miami maakt ontwerpen mogelijk op het grensvlak van scheikunde en biologie
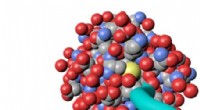
- Nieuw algoritme zorgt voor snellere, diervrije chemische toxiciteitstesten

- Onderzoekers ontwikkelen katalysator voor selectieve omzetting van reactieve lithiumverbindingen
 Dodelijke hittegolven zullen gebruikelijk zijn in Zuid-Azië, zelfs bij 1,5 graad opwarming
Dodelijke hittegolven zullen gebruikelijk zijn in Zuid-Azië, zelfs bij 1,5 graad opwarming Hoe machtsclassificatie te berekenen
Hoe machtsclassificatie te berekenen  Wildvuur van gletsjer dwingt evacuaties af, Yosemite gaat weer open
Wildvuur van gletsjer dwingt evacuaties af, Yosemite gaat weer open Hoe zwaar is het element neon?
Hoe zwaar is het element neon?  Wat de landbouw kan leren van termieten en schimmels
Wat de landbouw kan leren van termieten en schimmels  Simulaties demonstreren mogelijke mechanismen voor de vorming van zwarte gaten met gemiddelde massa in bolvormige sterrenhopen
Simulaties demonstreren mogelijke mechanismen voor de vorming van zwarte gaten met gemiddelde massa in bolvormige sterrenhopen  Waar is Deicer van gemaakt?
Waar is Deicer van gemaakt?  Wiskunde gebruiken om de sekseverschillen bij dinosaurussen te onderzoeken
Wiskunde gebruiken om de sekseverschillen bij dinosaurussen te onderzoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

