
Wetenschap
Maximaal aantal waterstofbindingen in ijs?
Dit is waarom:
* Vorming van waterstofbruggen: Een waterstofbinding treedt op wanneer een waterstofatoom wordt aangetrokken tot een sterk elektronegatief atoom (zoals zuurstof) in een ander molecuul.
* Structuur van watermolecuul: Water heeft twee waterstofatomen en één zuurstofatoom. Het zuurstofatoom heeft twee eenzame paren elektronen.
* IJstructuur: In ijs vormt elk watermolecuul vier waterstofbruggen. Twee van deze bindingen worden gevormd met de twee waterstofatomen van het watermolecuul, en de andere twee bindingen worden gevormd met de enige paren elektronen op het zuurstofatoom.
Deze tetraëdrische opstelling van waterstofbruggen is wat ijs zijn kristallijne structuur geeft en verklaart de relatief lage dichtheid in vergelijking met vloeibaar water.
 Afbeelding:Rook verduistert een groot deel van de Pacific Northwest
Afbeelding:Rook verduistert een groot deel van de Pacific Northwest Geef vijf voorbeelden van natuurlijke hulpbronnen in de IT -industrie?
Geef vijf voorbeelden van natuurlijke hulpbronnen in de IT -industrie?  Hoe is ecologie gerelateerd aan andere disciplines?
Hoe is ecologie gerelateerd aan andere disciplines?  Vluchten geannuleerd tijdens de ergste zandstorm in China in tien jaar
Vluchten geannuleerd tijdens de ergste zandstorm in China in tien jaar Hoe extratropische interacties tussen oceaan en atmosfeer kunnen bijdragen aan de variabiliteit van straalstromen
Hoe extratropische interacties tussen oceaan en atmosfeer kunnen bijdragen aan de variabiliteit van straalstromen
Hoofdlijnen
- Wat zijn de feiten over evolutie?
- Een garnalenverhaal - winnaars en verliezers in klimaatverandering
- Hoe wordt het genoemd als een procedure waarin iets is gemeten of waargenomen buiten het levende organisme?
- Wat is het verschil tussen een detective en wetenschapper?
- Waarom hebben eencellige organismen geen complexe structuren nodig voor gasuitwisseling?
- Hoe circuleert zuurstof tussen de boom en de vos?
- Hoe worden individuele subeenheden van macromoleculen genoemd?
- Wat vormt een genenpool van bevolking?
- Hoe ziet het zaad van Gerbera eruit?
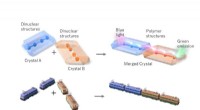
- Gekoppelde lanthaniden schijnen licht op het gebied van kristaltechniek
- Met deze nieuwe alfa-gel, de crème van alle huidcrèmes zou hier kunnen zijn

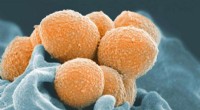
- Onderzoek identificeert mogelijk doelwit voor streptokokkenvaccin
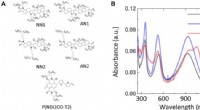
- Fysica van ladingstransport van een unieke klasse van geconjugeerde polymeren met stijve staven
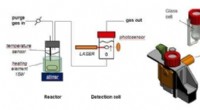
- Nieuw eenvoudig apparaat verbetert de analyse van de reactiekinetiek aanzienlijk
 Welk type berg in niet gevormd vanwege plaatbotsing?
Welk type berg in niet gevormd vanwege plaatbotsing?  Welk element wordt gebruikt om permanante magneten te maken?
Welk element wordt gebruikt om permanante magneten te maken?  Een genetische trigger voor de Cambrische explosie ontrafeld?
Een genetische trigger voor de Cambrische explosie ontrafeld?  Nieuwe studie detecteert het rinkelen van de wereldwijde atmosfeer
Nieuwe studie detecteert het rinkelen van de wereldwijde atmosfeer Wanneer zweet verdampt en de watermoleculen warmte-energie absorberen, waarom is dit dan belangrijk?
Wanneer zweet verdampt en de watermoleculen warmte-energie absorberen, waarom is dit dan belangrijk?  Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
Nieuw apparaat zoomt in op microbengedrag op de juiste schaal Wat is de klasse van clubschimmels?
Wat is de klasse van clubschimmels?  's Werelds dunste, lichtste signaalversterker maakt bio-instrumentatie mogelijk met minder ruis
's Werelds dunste, lichtste signaalversterker maakt bio-instrumentatie mogelijk met minder ruis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

