
Wetenschap
Welke ionen worden gevormd door de verschillende families?
Groepen 1 &2 (Alkali Metals &Alkaline Earth Metals)
* Groep 1 (Alkali metalen): Deze metalen vormen +1 ionen. Ze verliezen één elektron om een stabiele elektronenconfiguratie te bereiken.
* Voorbeeld:natrium (NA) vormt na+
* Groep 2 (Alkaline Earth Metals): Deze metalen vormen +2 ionen. Ze verliezen twee elektronen om een stabiele elektronenconfiguratie te bereiken.
* Voorbeeld:magnesium (mg) vormt mg+2
Groep 13 (boorgroep)
* Deze groep vormt +3 ionen in het algemeen. Ze verliezen drie elektronen om een stabiele configuratie te bereiken. Er zijn echter enkele uitzonderingen.
* Voorbeeld:Aluminium (AL) vormen Al+3
Groep 14 (Carbon Group)
* Elementen in deze groep vormen de neiging om een verscheidenheid aan ionen te vormen, vaak met covalente binding.
* Voorbeeld:koolstof (C) kan zowel +4 als -4 ionen vormen, maar deze worden zelden gezien als onafhankelijke ionen.
Groep 15 (stikstofgroep)
* Deze elementen hebben de neiging om -3 -ionen te vormen en drie elektronen te krijgen om een stabiele configuratie te bereiken.
* Voorbeeld:stikstof (n) vormt n-3
Groep 16 (zuurstofgroep)
* Deze elementen hebben de neiging om -2 -ionen te vormen en twee elektronen te krijgen om een stabiele configuratie te bereiken.
* Voorbeeld:zuurstof (O) vormt O-2
Groep 17 (halogenen)
* Deze elementen hebben de neiging om -1 -ionen te vormen en één elektron te krijgen om een stabiele configuratie te bereiken.
* Voorbeeld:chloor (CL) vormt Cl-
Groep 18 (edelgassen)
* Nobele gassen zijn over het algemeen niet -reactief omdat ze een volledige buitenste schaal van elektronen hebben. Ze vormen zelden ionen.
overgangsmetalen
* Overgangsmetalen kunnen meerdere ionen vormen vanwege de betrokkenheid van D-orbitalen. Ze kunnen elektronen verliezen van zowel de S- als D -orbitalen.
* Voorbeeld:ijzer (Fe) kan Fe+2 en Fe+3 -ionen vormen.
belangrijke opmerkingen:
* Uitzonderingen: Er zijn altijd uitzonderingen op deze algemene trends. Sommige elementen vormen ionen met verschillende ladingen en sommige vormionen die niet typisch zijn voor hun groep.
* opladen: De lading van een ion wordt bepaald door het aantal verkregen of verloren elektronen. Een positieve lading duidt op een ion dat elektronen heeft verloren, en een negatieve lading duidt op een ion dat elektronen heeft gewonnen.
* ionische verbindingen: Wanneer metalen en niet -metalen reageren, vormen ze ionische verbindingen. Deze verbindingen worden bij elkaar gehouden door elektrostatische krachten tussen positief geladen kationen en negatief geladen anionen.
Ik hoop dat deze uitleg helpt!
 Is een polymeerverf hetzelfde als gouache?
Is een polymeerverf hetzelfde als gouache?  Wat is de relatie tussen Salinty -dichtheid en temperatuur van zeewater?
Wat is de relatie tussen Salinty -dichtheid en temperatuur van zeewater?  Onderzoek toont aan hoe AI in slechts 30 minuten antibioticaresistentie kan detecteren
Onderzoek toont aan hoe AI in slechts 30 minuten antibioticaresistentie kan detecteren  Wat zijn 4 indicatoren om een chemische verandering te identificeren heeft plaatsgevonden?
Wat zijn 4 indicatoren om een chemische verandering te identificeren heeft plaatsgevonden?  Zwavelzuur wordt op zinkkorrels gegoten?
Zwavelzuur wordt op zinkkorrels gegoten?
 Schade veroorzaakt door een Tornado
Schade veroorzaakt door een Tornado  Kun je drie interacties noemen die kunnen plaatsvinden in een omgeving als Point Pelee?
Kun je drie interacties noemen die kunnen plaatsvinden in een omgeving als Point Pelee?  Internationaal team meldt dat verzuring van de oceaan zich snel verspreidt in de Noordelijke IJszee
Internationaal team meldt dat verzuring van de oceaan zich snel verspreidt in de Noordelijke IJszee Opwarmende zeeën wrak Great Barrier Reefs hergroei
Opwarmende zeeën wrak Great Barrier Reefs hergroei Hoe een eenvoudig weerstation te maken
Hoe een eenvoudig weerstation te maken
Hoofdlijnen
- Onderzoek laat zien hoe bloedcellen van vorm veranderen
- Bij het vormen van nieuwe DNA -moleculen elke streng van uw handeling als een?
- Wetenschappers ontdekken hoe bijen tijdens de bestuiving natuurlijke medicijnen tegen parasitaire infecties activeren
- Wat draagt bij aan natuurlijke selectie?
- Nieuw algoritme lost eeuwenoud probleem op voor koraalrifwetenschappers
- Wat is een cirkelvormig DNA -streng dat wordt gebruikt in recombinant DNA?
- Hoeveel parasieten kan een vogel bij zich dragen?
- Hoe wordt DNA-splitsing gebruikt in de biotechnologie?
- Wat is ES in de wetenschap?
- Nieuwe infraroodbeeldvormingstechniek onthult moleculaire oriëntatie van eiwitten in zijdevezels
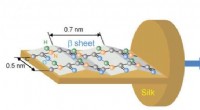
- Wetenschappers ontdekken verbindingen die hadden kunnen helpen bij het ontstaan van leven op aarde

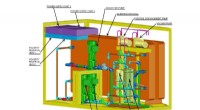
- Nrl ontvangt patent voor koolstofafvangapparaat - een belangrijke stap in de productie van synthetische brandstof uit zeewater
- MOF's kunnen lastige gassen detecteren en sorteren

- Simulaties laten zien hoe bèta-amyloïde neurale cellen kan doden

 Video:We vroegen een NASA-wetenschapper:heeft Mars ooit op de aarde geleken?
Video:We vroegen een NASA-wetenschapper:heeft Mars ooit op de aarde geleken?  Digitaal verbeterd:Estland maakt einde aan bureaucratie
Digitaal verbeterd:Estland maakt einde aan bureaucratie Wetenschappers ontdekken hoe twee eiwitten helpen cellen gezond te houden
Wetenschappers ontdekken hoe twee eiwitten helpen cellen gezond te houden  Onderzoekers bevestigen dat schaal van belang is bij het bepalen van de kwetsbaarheid van zoetwatervissen voor klimaatveranderingen
Onderzoekers bevestigen dat schaal van belang is bij het bepalen van de kwetsbaarheid van zoetwatervissen voor klimaatveranderingen  Lichaamsondersteuningsapparaat helpt mensen weer te leren lopen na een beroerte, trauma
Lichaamsondersteuningsapparaat helpt mensen weer te leren lopen na een beroerte, trauma Turbulentie in interstellaire gaswolken onthult multifractale structuren
Turbulentie in interstellaire gaswolken onthult multifractale structuren Wat is de oppervlaktetemperatuur van de aarde in graden Fahrenheit en Celsius?
Wat is de oppervlaktetemperatuur van de aarde in graden Fahrenheit en Celsius?  Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen
Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

