
Wetenschap
Hoe wordt een booratoom stabiel?
Borons elektronische configuratie
* Boron heeft een atoomnummer van 5, wat betekent dat het 5 protonen en 5 elektronen heeft.
* De elektronenconfiguratie is 1S² 2S² 2P¹. Dit betekent dat het 3 elektronen heeft in zijn buitenste schaal (de 2e schaal).
De octetregel
* Atomen streven naar stabiliteit door een volledige buitenste schaal van elektronen te bereiken. Dit staat bekend als de octetregel, wat in het algemeen betekent dat 8 elektronen in hun buitenste schaal worden.
* Er zijn echter uitzonderingen en Boron is er een van.
Borons stabiliteit
* Boron bereikt stabiliteit door covalente bindingen te vormen met andere atomen.
* Door zijn ene elektron te delen in de 2p orbitale, kan Boron een stabiele configuratie bereiken met 4 elektronen in de buitenste schaal (2 uit de 2S orbital en 2 uit de gedeelde elektronen).
* Dit staat bekend als het "onvolledige octet" uitzondering op de Octet -regel.
Voorbeelden van de stabiliteit van Boron
* boron trifluoride (bf3): Boron deelt zijn drie valentie -elektronen met drie fluoratomen en vormt drie covalente bindingen. Dit geeft Boron in totaal zes elektronen in de buitenste schaal.
* Borane (BH3): Boron vormt drie covalente bindingen met waterstofatomen, waardoor een vergelijkbare stabiele configuratie wordt bereikt.
Samenvattend:
Boron wordt stabiel door covalente bindingen te vormen met andere atomen, zijn elektronen te delen om een stabiele elektronenconfiguratie te bereiken, zelfs als het geen volledig octet heeft.
 Lijst met unieke planten voor loofbossen
Lijst met unieke planten voor loofbossen Minder El Niño en La Niña evenementen in een warmere wereld
Minder El Niño en La Niña evenementen in een warmere wereld Hoe beschermen pinguïns zichzelf tegen vijanden?
Hoe beschermen pinguïns zichzelf tegen vijanden?  Catastrofale uitbarsting overstromingen uitgehouwen Greenlands Grand Canyon
Catastrofale uitbarsting overstromingen uitgehouwen Greenlands Grand Canyon Simulaties identificeren ontbrekende schakel om koolstof in diepe aardreservoirs te bepalen
Simulaties identificeren ontbrekende schakel om koolstof in diepe aardreservoirs te bepalen
Hoofdlijnen
- Het Australische Great Barrier Reef heeft moeite om te overleven
- Wat is het dikke buitenmembraan van acoliet?
- Is de zeester externe of interne ontwikkeling?
- Zeeslakken weten hoe ze hun huisvestingskosten moeten begroten
- De wetenschap zegt:waarom wetenschappers planten- en dierengenomen waarderen
- Wat sponzen ons kunnen vertellen over de evolutie van de hersenen
- Hoe gelukkig te zijn in een relatie
- Een dieper begrip van hoe cellen bewegen en bij elkaar blijven
- Waarom is recombinant DNA een nieuwe vorm van DNA?
- Kijken hoe moleculen in realtime worden gesplitst
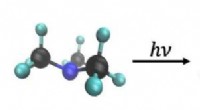
- Foto-initiatoren voor tandvullingen, contactlenzen en kunstgebitten

- Nieuwe synthetische biologietools ontgrendelen complexe plantengineering
- Niet-vervuilend membraan voor bovenkleding

- Ontwikkelen van een blokcopolymeer dat veiligere, stabielere batterijen mogelijk maakt

 Energie reist door de ruimte als ritmische golven?
Energie reist door de ruimte als ritmische golven?  Wat gebeurt er met aluminium- en zinknitraat?
Wat gebeurt er met aluminium- en zinknitraat?  Wereldwijde virussen:oude haat bevorderen
Wereldwijde virussen:oude haat bevorderen Hoe beïnvloedt het zonnestelsel de aarde?
Hoe beïnvloedt het zonnestelsel de aarde?  Gefocuste röntgenstralen laten zien hoe stenen onder hoge druk veranderen in verschillende materialen
Gefocuste röntgenstralen laten zien hoe stenen onder hoge druk veranderen in verschillende materialen Wat zijn de smakelijke subsystemen?
Wat zijn de smakelijke subsystemen?  Natuurkundigen laten zien hoe geluid via vacuüm kan worden overgedragen
Natuurkundigen laten zien hoe geluid via vacuüm kan worden overgedragen  Wat is de studie van hoe een interne structuur van een organismen functioneert?
Wat is de studie van hoe een interne structuur van een organismen functioneert?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

