
Wetenschap
Wat is de massa van 455 ml ethaangas C2H6 bij STP?
1. Begrijp STP
STP staat voor standaard temperatuur en druk. Het wordt gedefinieerd als:
* Temperatuur: 0 ° C (273.15 K)
* Druk: 1 geldautomaat (101.325 kPa)
2. Gebruik de ideale gaswet
De ideale gaswet relateert druk (P), volume (V), aantal mol (N), de gasconstante (R) en temperatuur (T):
PV =NRT
3. Bepaal de molaire ethaanmassa (c₂h₆)
* Koolstof (C) heeft een molaire massa van 12,01 g/mol
* Waterstof (H) heeft een molaire massa van 1,01 g/mol
* Ethaan (c₂h₆) heeft een molaire massa van (2 * 12.01) + (6 * 1.01) =30,07 g/mol
4. Bereken het aantal mol (n)
* Converteer het volume van ml naar l:455 ml =0,455 l
* Herschik de ideale gaswet om op te lossen voor n:n =pv / rt
* Gebruik de juiste waarde voor de gasconstante R:0,0821 l · atm/(mol · k)
* Sluit de waarden aan:n =(1 atm * 0,455 l) / (0,0821 l · atm / (mol · k) * 273.15 k)
* Bereken:n ≈ 0,0204 mol
5. Bereken de massa
* Vermenigvuldig het aantal mol met de molaire ethaanmassa:massa =n * molaire massa
* massa ≈ 0,0204 mol * 30,07 g/mol
* massa ≈ 0,614 g
Daarom is de massa van 455 ml ethaangas bij STP ongeveer 0,614 gram.
 Poreuze materialen meten temperatuur op moleculair niveau
Poreuze materialen meten temperatuur op moleculair niveau Welke vergelijking brengt de chemische stof O Fe Fe2O3 correct in evenwicht?
Welke vergelijking brengt de chemische stof O Fe Fe2O3 correct in evenwicht?  Neutronen brengen atomaire kaart van het virale replicatiemechanisme van COVID-19 in kaart
Neutronen brengen atomaire kaart van het virale replicatiemechanisme van COVID-19 in kaart Een vloeistof kan een gas- of vloeistof waar onwaar zijn?
Een vloeistof kan een gas- of vloeistof waar onwaar zijn?  Welke stof is correct gekoppeld aan het type binding br2 polair covalent?
Welke stof is correct gekoppeld aan het type binding br2 polair covalent?
 Enorme ijzervoorraden in West-Siberië kunnen afkomstig zijn van onder een oude zee
Enorme ijzervoorraden in West-Siberië kunnen afkomstig zijn van onder een oude zee 'Darwin's plas' laat zien hoe nieuwe soorten kunnen ontstaan zonder geografische scheiding
'Darwin's plas' laat zien hoe nieuwe soorten kunnen ontstaan zonder geografische scheiding  Hoe strategieën voor ongediertebestrijding het bedrijfsresultaat beïnvloeden
Hoe strategieën voor ongediertebestrijding het bedrijfsresultaat beïnvloeden  Oude schelpenshows waren 70 miljoen jaar geleden een half uur korter
Oude schelpenshows waren 70 miljoen jaar geleden een half uur korter Waarom de productie van giftige methylkwik toenam in een estuarium van de Grote Meren
Waarom de productie van giftige methylkwik toenam in een estuarium van de Grote Meren
Hoofdlijnen
- Bijen zijn verbazingwekkend goed in het nemen van beslissingen – en ons computermodel legt uit hoe dat mogelijk is
- Zaai-tussengezaaide bodembedekkers bieden voordelen voor de V3-maïsoogst
- Stropers richten zich op Afrikaanse leeuwen, gieren met vergif
- Maak kennis met de nieuwe insectendodende dennenbomen van Utah:onderzoek modelleert de impact van de balsemwollige adelgid
- Waarom zien we geen robotbeschavingen die zich snel uitbreiden over het universum?
- Druk jezelf uit:hoe zygoten ingeprent genen uitzoeken
- Hoe het influenzavirus efficiënte virale RNA-replicatie bereikt
- Onderzoek toont aan hoe kunststoffen de biodiversiteit van het zeeleven bedreigen
- Wat biedt ATP?
- Een fosfineoxidekatalysator gebruiken om nucleofiele substitutiereacties van alcoholen groener te maken

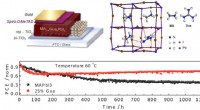
- Guanidinium stabiliseert perovskiet-zonnecellen met een efficiëntie van 19 procent
- Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen

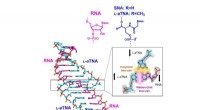
- De helix van het leven:nieuwe studie laat zien hoe RNA zich stabiel bindt aan kunstmatige nucleïnezuren
- Designer-eiwitten vormen draden en roosters op een mineraal oppervlak

 Marriott riskeert boete van 123 miljoen dollar in VK voor datalek
Marriott riskeert boete van 123 miljoen dollar in VK voor datalek Zullen koolstofnanobuisjes indiumtinoxide vervangen?
Zullen koolstofnanobuisjes indiumtinoxide vervangen?  Wanneer moeten banken schulden najagen? Een nieuwe methode zou hen kunnen helpen beslissen
Wanneer moeten banken schulden najagen? Een nieuwe methode zou hen kunnen helpen beslissen  Voor het eerst kunnen we het hele jaar door de dikte van Arctisch zee-ijs meten
Voor het eerst kunnen we het hele jaar door de dikte van Arctisch zee-ijs meten 2e grote sneeuwstorm in een week dekens Noordoost
2e grote sneeuwstorm in een week dekens Noordoost Onderzoek maakt weg vrij voor nieuwe bron voor leukemiemedicijn
Onderzoek maakt weg vrij voor nieuwe bron voor leukemiemedicijn Uit audit blijkt dat 70 procent van de visverwerkingsfabrieken in British Columbia niet voldoen aan de milieuregelgeving
Uit audit blijkt dat 70 procent van de visverwerkingsfabrieken in British Columbia niet voldoen aan de milieuregelgeving Waterefficiëntie in landelijke gebieden wordt slechter, zelfs als het verbetert in stedelijke centra
Waterefficiëntie in landelijke gebieden wordt slechter, zelfs als het verbetert in stedelijke centra
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

