
Wetenschap
Hoe verschillen isotopen van An van elkaar?
Hier is een uitsplitsing:
* atomen: Alle atomen van een specifiek element hebben hetzelfde aantal protonen, dat het element definieert. Dit nummer wordt het atoomnummer genoemd .
* isotopen: Isotopen van hetzelfde element hebben hetzelfde aantal protonen maar verschillende aantallen neutronen.
* Massienummer: De som van protonen en neutronen in een atoom wordt het massacummer genoemd . Aangezien isotopen verschillende aantallen neutronen hebben, hebben ze verschillende massagummers.
Bijvoorbeeld:
Laten we het element koolstof (c) bekijken:
* carbon-12 (¹²C): Heeft 6 protonen en 6 neutronen (massaummer =12).
* carbon-14 (¹⁴C): Heeft 6 protonen en 8 neutronen (massaummer =14).
Beide zijn koolstofatomen omdat ze 6 protonen hebben, maar ze hebben verschillende aantallen neutronen, waardoor ze isotopen zijn.
Belangrijke verschillen als gevolg van verschillende neutronen:
* massa: Isotopen hebben verschillende massa's vanwege het verschillende aantal neutronen.
* Radioactiviteit: Sommige isotopen zijn radioactief, wat betekent dat ze na verloop van tijd vervallen en deeltjes en energie uitzenden. Dit is vaak te wijten aan een onstabiele verhouding van protonen en neutronen.
* chemische eigenschappen: Hoewel het aantal neutronen de massa beïnvloedt, verandert het de chemische eigenschappen van een element niet significant. Het aantal protonen bepaalt hoe een element zal binden aan andere atomen.
Belangrijke opmerking: Het specifieke element dat u "AN" noemt, is geen herkend elementsymbool. Geef het werkelijke element waarin u geïnteresseerd bent en ik kan meer specifieke informatie over de isotopen verstrekken.
 Toestemmingsformulieren voor onderzoek:zijn ze in 25 jaar verbeterd?
Toestemmingsformulieren voor onderzoek:zijn ze in 25 jaar verbeterd?  Nieuwe analytische benadering voor het detecteren en karakteriseren van onbekende soorten PFAS in het milieu
Nieuwe analytische benadering voor het detecteren en karakteriseren van onbekende soorten PFAS in het milieu  Wat is het oplosmiddel in solide oplossing van een gouden ring?
Wat is het oplosmiddel in solide oplossing van een gouden ring?  Wat is de polariteit wanneer de aardklem is aangesloten op negatief lassen?
Wat is de polariteit wanneer de aardklem is aangesloten op negatief lassen?  Wat drijft fotosynthese aan?
Wat drijft fotosynthese aan?
Hoofdlijnen
- Verfijning van pesticiden om ongedierte te doden, geen bijen
- Ziek van de Mexicaanse griep? Giftige algen kunnen de volgende grote bedreiging zijn
- Wat experimenteerde Frederick met muizen?
- Westerse steden proberen te voorkomen dat hongerige beren ravage aanrichten
- Wat at Megalodon? Alles wat het wilde, inclusief andere roofdieren
- Lab een stap dichter bij het begrijpen hoe het leven op aarde begon
- 2 Integrale membraaneiwitten zoals transport worden permanent bevestigd aan cellulaire membranen na gesynthetiseerd welke organel zou helpen bij het transport?
- Dieetbeperking en levensduur bij mannelijke en hermafrodiete wormen
- Waarom het ontwikkelen van zenuwcellen een verkeerde afslag kan nemen
- Natuurlijke antibiotica multi-level aanvalsstrategie voorkomt resistentie
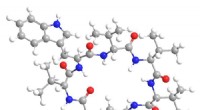
- Nieuw materiaal maakt de weg vrij voor op afstand bestuurbare medicatie en elektronische pillen

- Gewone microben werken samen om polymeercomposieten af te breken

- Ecologische energie-accu gemaakt van vanilline

- Een nieuwe methode voor de vorming van gefluoreerde moleculaire ringen
 Welke laag van de atmosfeer heeft weinig thermische energie?
Welke laag van de atmosfeer heeft weinig thermische energie?  Wetenschappelijke methode en zijn delen definiëren?
Wetenschappelijke methode en zijn delen definiëren?  Twitter brengt verkiezingslabels terug voor Amerikaanse kandidaten voor 2020
Twitter brengt verkiezingslabels terug voor Amerikaanse kandidaten voor 2020 Langlevende geluidsgolven in kristallijne vaste stoffen
Langlevende geluidsgolven in kristallijne vaste stoffen Hoe u uzelf kunt beschermen tegen de 'spear phishing'-hacktechniek
Hoe u uzelf kunt beschermen tegen de 'spear phishing'-hacktechniek  Australiërs waarschuwden dat de ergste bosbranden nog moeten komen
Australiërs waarschuwden dat de ergste bosbranden nog moeten komen Koude moleculen op ramkoers
Koude moleculen op ramkoers Spinnen die eruit zien als bruine kluizenaars Spinnen
Spinnen die eruit zien als bruine kluizenaars Spinnen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

