
Wetenschap
Hoeveel valentieposities heeft zuurstof voor binding?
Dit is waarom:
* Elektronenconfiguratie: Zuurstof heeft een elektronenconfiguratie van 1S²2S²2P⁴. Dit betekent dat het zes elektronen heeft in zijn buitenste schaal (de 2e schaal).
* valentie -elektronen: De valentie -elektronen zijn de elektronen in de buitenste schaal, die betrokken zijn bij chemische binding. Zuurstof heeft zes valentie -elektronen.
* octetregel: Zuurstof wil een stabiel octet (acht elektronen) bereiken in de buitenste schaal. Om dit te doen, moet het twee winnen Meer elektronen.
* binding: Dit betekent dat zuurstof twee covalente bindingen kan vormen en twee elektronen met andere atomen kan delen.
Voorbeelden:
* In water (H₂o) vormt zuurstof twee enkele bindingen met twee waterstofatomen.
* In koolstofdioxide (CO₂) vormt zuurstof twee dubbele bindingen met een koolstofatoom.
 Koolstofafvangtechnologie verwijdert CO2 van energiecentrales zoals duikuitrusting
Koolstofafvangtechnologie verwijdert CO2 van energiecentrales zoals duikuitrusting Zijn Na en F een polaire of niet-polaire binding?
Zijn Na en F een polaire of niet-polaire binding?  Waarom gebruik je lakmoespapier om het verschil tussen zuur en base te zien?
Waarom gebruik je lakmoespapier om het verschil tussen zuur en base te zien?  Hoe zit het met de volgende notaties is de juiste adellijke gasconfiguratie voor SR?
Hoe zit het met de volgende notaties is de juiste adellijke gasconfiguratie voor SR?  Hoe een badspons een biobased industrieel filter wordt
Hoe een badspons een biobased industrieel filter wordt
 Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie
Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie Het weer moet ondanks klimaatverandering voorspelbaar blijven
Het weer moet ondanks klimaatverandering voorspelbaar blijven Wat is de bron van warmte en licht voor alle planten?
Wat is de bron van warmte en licht voor alle planten?  Detectie van hydrothermale bronnen in vulkanische meren
Detectie van hydrothermale bronnen in vulkanische meren Waarom veranderen wetenschappelijke theorieën?
Waarom veranderen wetenschappelijke theorieën?
Hoofdlijnen
- De samenstelling van de darmmicrobiota kan de besluitvorming beïnvloeden
- Wat zijn de twee soorten observatie in de wetenschappelijke methode?
- Hoe bacteriën virale invasie herkennen en de immuunafweer activeren
- Onderzoekers breiden de kracht van genbewerking uit door een nieuwe klasse van DNA-basiseditors te ontwikkelen
- Houden drie maaltijden per dag schimmels weg?
- Ideeën voor het maken van een 3-D DNA-standaard voor middelbare school
- Een dodelijke ziekte heeft zeven Australische kikkersoorten met uitsterven gedreven. Maar deze bedreigde kikker vecht terug
- Welk water wordt getransporteerd van een wortels naar zijn bladeren in het weefsel?
- Infecteert COVID-19 wilde dieren? We testen soorten, van vleermuizen tot zeehonden, om erachter te komen
- Kristallisatie bij lage temperatuur van fasezuiver α-formamidiniumloodjodide mogelijk gemaakt door studie

- Verbeterde waterafstotende oppervlakken ontdekt in de natuur

- Onderzoekers creëren nieuwe goedkope, duurzaam materiaal voor het verminderen van lucht- en watervervuiling

- Induced-fit adsorbens voor acetyleen
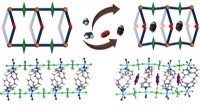
- Blauwe paddestoelkleurstof gebruikt om nieuw fluorescerend hulpmiddel voor celbiologen te ontwikkelen

 Welke organismen die organische bronnen van koolstof en energie vereisen?
Welke organismen die organische bronnen van koolstof en energie vereisen?  Natuurkundigen gaan op jacht naar een lang gezochte kwantumgloed
Natuurkundigen gaan op jacht naar een lang gezochte kwantumgloed EU stemt in met hervorming van grootste koolstofmarkt ter wereld
EU stemt in met hervorming van grootste koolstofmarkt ter wereld De verschillen in broederlijke en vaderlijke tweelingen
De verschillen in broederlijke en vaderlijke tweelingen Wat is het verschil tussen Lunar Eclipse en Solor Eclipse?
Wat is het verschil tussen Lunar Eclipse en Solor Eclipse?  Waarom vliegt een heteluchtballon niet in koude lucht?
Waarom vliegt een heteluchtballon niet in koude lucht?  Ernst van de droogte in het stroomgebied van de Gele Rivier in de afgelopen 55 jaar
Ernst van de droogte in het stroomgebied van de Gele Rivier in de afgelopen 55 jaar Door aardbevingen geteisterd deel van Kroatië ziet gapende zinkgaten ontstaan
Door aardbevingen geteisterd deel van Kroatië ziet gapende zinkgaten ontstaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

