
Wetenschap
Waarom is de moleculaire geometrie van water gebogen?
1. De elektronenconfiguratie van Oxygen: Zuurstof heeft zes elektronen in zijn buitenste schaal en het heeft er nog twee nodig om zijn octet te voltooien. Het bereikt dit door twee covalente bindingen te vormen met twee waterstofatomen.
2. Eige paren elektronen: Zuurstof heeft twee eenzame paren elektronen in de buitenste schaal. Deze enige paren afstoten de bindingsparen van elektronen en duwen de twee waterstofatomen dichter bij elkaar.
3. VSEPR -theorie: De theorie van de Valent Shell Electron Pair Repulsion (VSEPR) stelt dat elektronen rond een centraal atoom zich zullen regelen om afstoting te minimaliseren. De twee eenzame paren op zuurstof oefenen een sterkere afstotende kracht uit dan de bindingsparen, waardoor de waterstofatomen naar beneden worden geduwd, wat resulteert in een gebogen vorm.
4. Hybridisatie: De atoomorbitalen van zuurstof hybridiseren om vier SP3 hybride orbitalen te vormen. Twee van deze orbitalen vormen covalente bindingen met de waterstofatomen, terwijl de andere twee orbitalen worden bezet door de enige paren. Deze hybridisatie draagt verder bij aan de gebogen vorm.
Samenvattend: De gebogen vorm van water is een gevolg van de combinatie van de elektronenconfiguratie van zuurstof, eenzame paarafstand en de VSEPR -theorie. Deze gebogen vorm geeft water veel unieke eigenschappen, zoals zijn hoge polariteit en het vermogen om waterstofbruggen te vormen.
 Hoeveel elektronen zitten er in Au-200?
Hoeveel elektronen zitten er in Au-200?  Soorten luchtverontreiniging: smog en zure regen
Soorten luchtverontreiniging: smog en zure regen  Wanneer 15,0 g en NACIO3 20.0 Cr2O3 reageren die de reactie beperken?
Wanneer 15,0 g en NACIO3 20.0 Cr2O3 reageren die de reactie beperken?  Welke kleur ontstaat door het mengen van twee complementaire kleuren?
Welke kleur ontstaat door het mengen van twee complementaire kleuren?  Atomaire structuur van aluminiumlegeringen bestuderen voor de fabricage van moderne vliegtuigen
Atomaire structuur van aluminiumlegeringen bestuderen voor de fabricage van moderne vliegtuigen
 Loodhoudende benzine raakt leeg, eeuw na eerste waarschuwingen:UN
Loodhoudende benzine raakt leeg, eeuw na eerste waarschuwingen:UN Ogen in de lucht:hoe China's geavanceerde aardobservatiesysteem de mondiale vooruitgang vormgeeft
Ogen in de lucht:hoe China's geavanceerde aardobservatiesysteem de mondiale vooruitgang vormgeeft  De strijd om de toekomst van de landbouw:wat u moet weten
De strijd om de toekomst van de landbouw:wat u moet weten  Stijgende CO2 leidt tot veranderingen in de fotosynthese van landplanten
Stijgende CO2 leidt tot veranderingen in de fotosynthese van landplanten Mysterieuze gaten in Antarctisch zee-ijs verklaard door jarenlange robotgegevens
Mysterieuze gaten in Antarctisch zee-ijs verklaard door jarenlange robotgegevens
Hoofdlijnen
- Geherprogrammeerde menselijke bloedcellen zijn veelbelovend voor onderzoek naar ziekten
- Hoe classificeren we micro -organismen?
- Waarom laten mensen twee sets tanden groeien? Deze buideldieren herschrijven het verhaal van tandheelkundige evolutie
- Welke eigenschap deelt een virus met andere levende wezens het vermogen?
- Molecuul dicteert hoe stamcellen reizen
- Wat de levendige pigmenten van vogelveren ons kunnen leren over hoe evolutie werkt
- Welk proces voeren Ribosomes uit?
- Welk molecuul is verantwoordelijk voor het transporteren van de genetische informatie gecodeerd op DNA van de kern naar het ribosoom?
- Uitkomsten van ziekten verschillen per nieuwe gastheersoort in experimenten met virusspillover
- Onderzoekers ontwikkelen nieuwe meetmethode in moleculaire elektronica
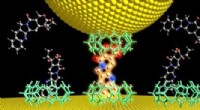
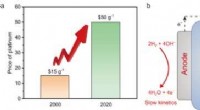
- Goedkope legering concurreert met duur platina om brandstofcellen te stimuleren
- Bioengineer wil virusbestrijders van de natuur veranderen in krachtige medicijnen
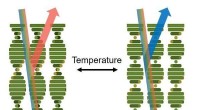
- Kleurveranderende coatings geactiveerd door temperatuurveranderingen
- Vormveranderende materialen:licht gebruiken om macroscopische structuren te herschikken
 Om klimaatmodellen te verbeteren, een internationaal team wendt zich tot archeologische gegevens
Om klimaatmodellen te verbeteren, een internationaal team wendt zich tot archeologische gegevens Natures metselwerk:de eerste stappen in hoe dunne eiwitvellen polyedrische schelpen vormen
Natures metselwerk:de eerste stappen in hoe dunne eiwitvellen polyedrische schelpen vormen Er is mogelijk tot 70 keer meer waterstof in de kern van de aarde dan in de oceanen
Er is mogelijk tot 70 keer meer waterstof in de kern van de aarde dan in de oceanen Voorbij geluid:roodoogboomkikkers gebruiken geluid en trillingen bij het zoeken naar vrienden en agressie
Voorbij geluid:roodoogboomkikkers gebruiken geluid en trillingen bij het zoeken naar vrienden en agressie Onderzoekers waarschuwen voor phishing-berichten die smartphones aanvallen
Onderzoekers waarschuwen voor phishing-berichten die smartphones aanvallen Onderwatervulkanen:hoe kleurveranderingen van de oceaan een aanstaande uitbarsting kunnen signaleren
Onderwatervulkanen:hoe kleurveranderingen van de oceaan een aanstaande uitbarsting kunnen signaleren  Wat is de aard van de grafiek tussen kinetische energie en massa bij constante snelheid?
Wat is de aard van de grafiek tussen kinetische energie en massa bij constante snelheid?  Wat zijn de 4 soorten luchtmassa?
Wat zijn de 4 soorten luchtmassa?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

