
Wetenschap
Wat gebeurt er als AL reageert met FESO4?
reactie:
2 AL (S) + 3 FESO₄ (aq) → Al₂ (So₄) ₃ (aq) + 3 Fe (s)
Verklaring:
* aluminium (AL) is reactiever dan ijzer (Fe) . Dit betekent dat aluminium een sterkere neiging heeft om elektronen te verliezen en positieve ionen te vormen.
* Wanneer aluminium wordt geplaatst in een oplossing van ijzer (II) sulfaat, verplaatst het de ijzerionen van de oplossing.
* aluminium (AL) verliest elektronen en vormt aluminiumionen (Al³⁺).
* ijzer (Fe) ionen krijgen elektronen en vormen ijzeratomen (Fe).
* De sulfaationen (So₄²⁻) blijven in oplossing.
* aluminiumsulfaat (Al₂ (So₄) ₃) wordt gevormd, die oplosbaar is in water.
* ijzer (Fe) wordt afgezet als een vaste stof.
Observaties:
* Je zou de vorming van een grijs-zwarte vaste stof (ijzer) aan de onderkant van de container observeren.
* De oplossing zou van kleur veranderen van lichtgroen (feso₄) in kleurloos (al₂ (So₄) ₃).
Opmerking: Deze reactie is een klassiek voorbeeld van een enkele verplaatsingsreactie en demonstreert de reactiviteitsreeks van metalen. Het meer reactief metaal zal altijd het minder reactieve metaal uit zijn zoutoplossing verplaatsen.
 Atomen van elementen in een groep op het periodiek systeem hebben vergelijkbare chemische eigenschappen. Deze gelijkenis is het meest gerelateerd aan atomen?
Atomen van elementen in een groep op het periodiek systeem hebben vergelijkbare chemische eigenschappen. Deze gelijkenis is het meest gerelateerd aan atomen?  Nieuw nanomateriaal ontwikkeld om watermoleculen te splitsen, verkrijgen van diwaterstof onder zonlicht
Nieuw nanomateriaal ontwikkeld om watermoleculen te splitsen, verkrijgen van diwaterstof onder zonlicht Hoeveel gram waterstof bevindt zich in 25,0 g water?
Hoeveel gram waterstof bevindt zich in 25,0 g water?  Is borax een samengesteld of heterogeen mengsel?
Is borax een samengesteld of heterogeen mengsel?  Wat zijn de twee Amerikaanse lasmaatschappij afkortingen voor boogprocessen die een buisvormige elektrode smelten met legeringen deoxidizers en slakvormers in hun cores?
Wat zijn de twee Amerikaanse lasmaatschappij afkortingen voor boogprocessen die een buisvormige elektrode smelten met legeringen deoxidizers en slakvormers in hun cores?
Hoofdlijnen
- Waarom moet het voedsel dat u eet, worden gewijzigd voor gebruik door uw cel?
- Wat is de tegenhanger van Petiole Dicot in Monocot?
- Hoe heet een virus dat zich voortplant in een bacterie?
- Welke bloedgroep is altijd heterozygoot?
- Behandeling voor honden verlicht de angst voor lawaaierig vuurwerk
- Cellulaire ademhaling bij de mens
- Bevindingen sonde cel samenwerking, massale migratie
- Hoe ziet Volvox -algen eruit?
- Wat is de functie van een schort in de wetenschap?
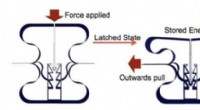
- Wetenschappers ontwerpen materiaal dat energie kan opslaan als een adelaarsgreep
- Onderzoek naar roamingreacties om nieuw licht te werpen op atmosferische moleculen

- De C-H-bindingen in koolwaterstoffen verbreken om complexe organische moleculen te synthetiseren
- Microbiële diefstal maakt afbraak van methaan mogelijk, giftige methylkwik
- Plastic web printen om de gsm-schermen van de toekomst te beschermen

 Verstedelijking en klimaatveranderingen kunnen in de toekomst een een-tweetje betekenen voor stroomgebieden, studie vondsten
Verstedelijking en klimaatveranderingen kunnen in de toekomst een een-tweetje betekenen voor stroomgebieden, studie vondsten Wat is de massa van een elastiekje?
Wat is de massa van een elastiekje?  Een getijdenklok instellen
Een getijdenklok instellen Elektrische draadeigenschappen van DNA gekoppeld aan kanker
Elektrische draadeigenschappen van DNA gekoppeld aan kanker Welke schaalgrootte gebruiken wetenschappers om atomen weer te geven?
Welke schaalgrootte gebruiken wetenschappers om atomen weer te geven?  Chimpansees bleken arm- en monduitdrukkingen te gebruiken om afstand over te brengen
Chimpansees bleken arm- en monduitdrukkingen te gebruiken om afstand over te brengen Hoe wetenschappers onze eerste interstellaire mysteriebezoeker ontdekten
Hoe wetenschappers onze eerste interstellaire mysteriebezoeker ontdekten Contrastmiddel voor tumordiagnostiek:fosforescerende metaal-organische coördinatiepolymeren voor optische beeldvorming
Contrastmiddel voor tumordiagnostiek:fosforescerende metaal-organische coördinatiepolymeren voor optische beeldvorming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

