
Wetenschap
Hoeveel gram NH3 kan worden geproduceerd uit 2.63 mol N2 en overtollig H2?
1. Evenwichtige chemische vergelijking:
De gebalanceerde chemische vergelijking voor de reactie van stikstof en waterstof om ammoniak te vormen is:
N₂ (g) + 3H₂ (g) → 2nh₃ (g)
2. Mol -verhouding:
De evenwichtige vergelijking vertelt ons dat 1 mol N₂ reageert om 2 mol NH₃ te produceren.
3. Bereken mol NH₃:
Omdat we 2,63 mol N₂ hebben, kunnen we de molverhouding gebruiken om de mol NH₃ geproduceerd te berekenen:
2.63 mol N₂ × (2 mol NH₃ / 1 mol N₂) =5,26 mol NH₃
4. Converteer mollen naar gram:
De molaire massa van NH₃ is 17,03 g/mol. Vermenigvuldig de mol NH₃ met zijn molaire massa om de gram te vinden:
5.26 Mol NH₃ × (17,03 g NH₃ / 1 mol NH₃) = 89,6 g NH₃
Daarom kan 89,6 gram NH₃ worden geproduceerd uit 2,63 mol N₂ en overtollig H₂.
 Waarom verandert de temperatuur van water tijdens het smelten?
Waarom verandert de temperatuur van water tijdens het smelten?  Welke ion is het hoogst in interstitiële vloeistof?
Welke ion is het hoogst in interstitiële vloeistof?  Veelzijdige ontwerpoptimalisatie voor superomnifobe oppervlakken
Veelzijdige ontwerpoptimalisatie voor superomnifobe oppervlakken Een alternatieve route voor het bestuderen van de intrinsieke eigenschappen van vastestofmaterialen
Een alternatieve route voor het bestuderen van de intrinsieke eigenschappen van vastestofmaterialen Nieuw proces voor het screenen van oude urinemonsters onthult voorheen onopgemerkte designermedicijnen
Nieuw proces voor het screenen van oude urinemonsters onthult voorheen onopgemerkte designermedicijnen
 Hoe AI het beter doet dan spreadsheets bij het modelleren van toekomstige volumes voor stadsafvalbeheer
Hoe AI het beter doet dan spreadsheets bij het modelleren van toekomstige volumes voor stadsafvalbeheer Is de wetenschap werkelijk beter in zelfcorrectie dan de journalistiek?
Is de wetenschap werkelijk beter in zelfcorrectie dan de journalistiek?  Trans-Pacific reis van atmosferische deeltjes
Trans-Pacific reis van atmosferische deeltjes Zeeoppervlaktetemperatuur en luchtkwaliteit:onderzoek uit de Yangtze-rivierdelta
Zeeoppervlaktetemperatuur en luchtkwaliteit:onderzoek uit de Yangtze-rivierdelta Niet alleen de koralen van de Golf van Aqaba overleven de klimaatverandering, maar hun nakomelingen kunnen dat ook
Niet alleen de koralen van de Golf van Aqaba overleven de klimaatverandering, maar hun nakomelingen kunnen dat ook
Hoofdlijnen
- Wat betekent nadh in de wetenschap?
- Bacteriën kunnen antibioticaresistentie via de bodem verspreiden
- Hoe meer en meer studenten de burgerwetenschapsbug te pakken krijgen
- Wat vonden de oude Grieken van fotosynthese?
- Gebruik reageerbuisexperimenten om te bestuderen hoe bacteriesoorten antibioticaresistentie ontwikkelen
- Wat is het eindresultaat van bemesting in termen van chromosomen -getallen?
- Wat is het sorteren in de wetenschap?
- Hoe klimaatverandering de aardappelteelt in Zuid-Korea beïnvloedt
- Waarom zijn cellen niet hetzelfde? Geef voorbeelden voor je antwoord?
- Nieuwe technologie zet zonlicht, water en koolstofdioxide om in acetaat en zuurstof voor hoogwaardige brandstoffen en chemicaliën
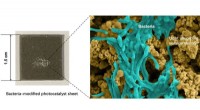
- Twee bacteriële co-culturen verbeteren de microbe-co-afbraak van dicarboximide-fungiciden

- Op jacht naar giftige stoffen in slib

- Nieuwe chemie voor het regelen van het vloeistofvolume in volumetrische additieve productie
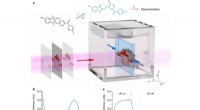
- Een snelle, gebruiksvriendelijke DNA-amplificatiemethode bij 37 Celsius

 Fragmenten van asteroïden zijn mogelijk over de kloof in het vroege zonnestelsel gesprongen
Fragmenten van asteroïden zijn mogelijk over de kloof in het vroege zonnestelsel gesprongen De energieniveaus van organische halfgeleiders afstemmen
De energieniveaus van organische halfgeleiders afstemmen Welke rol speelt een Woodlouse in ontleding?
Welke rol speelt een Woodlouse in ontleding?  Hoe stemt u tegen de spaartijd van de daglicht?
Hoe stemt u tegen de spaartijd van de daglicht?  Welke indicatoren worden gebruikt bij redoxtitratie?
Welke indicatoren worden gebruikt bij redoxtitratie?  India's liefdesrelatie met steenkool koelt af naarmate de druk op de sector toeneemt
India's liefdesrelatie met steenkool koelt af naarmate de druk op de sector toeneemt Vindt iedereen dat iemand anders in een groene auto moet rijden?
Vindt iedereen dat iemand anders in een groene auto moet rijden?  Reproductie van plantaardige cellen
Reproductie van plantaardige cellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

