
Wetenschap
Is waterstofbinding een sterke aantrekkelijke kracht.
Dit is waarom:
* sterker dan dipool-dipool interacties: Waterstofbindingen komen voort uit de speciale interactie tussen een waterstofatoom covalent gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor) en een eenzaam paar elektronen op een ander elektronegatief atoom. Dit creëert een sterke elektrostatische aantrekkingskracht.
* Zwakker dan covalente bindingen: Hoewel waterstofbindingen sterker zijn dan typische dipool-dipoolinteracties, zijn ze nog steeds aanzienlijk zwakker dan covalente bindingen. Dit komt omdat ze het delen van elektronen tussen atomen omvatten, terwijl waterstofbruggen voornamelijk elektrostatische interacties zijn.
Hier is een handige analogie:
Stel je een sterke magneet voor (covalente binding) die twee stukken metaal bij elkaar houdt. Stel je nu voor dat een zwakkere magneet (waterstofbinding) twee stukken metaal aantrekt, maar ze niet zo strak bij elkaar houdt.
Belang van waterstofbinding:
Ondanks dat hij zwakker is dan covalente bindingen, zijn waterstofbindingen cruciaal voor veel biologische en chemische processen, waaronder:
* watereigenschappen: Waterstofbindingen zijn verantwoordelijk voor het hoge kookpunt van water, oppervlaktespanning en het vermogen om als oplosmiddel te fungeren.
* eiwitstructuur: Waterstofbindingen spelen een cruciale rol bij het handhaven van de vorm en functie van eiwitten.
* DNA -structuur: Waterstofbindingen houden de twee DNA -strengen bij elkaar, waardoor replicatie en transcriptie mogelijk is.
Hoewel waterstofbindingen niet de sterkste krachten zijn, zijn ze nog steeds essentieel voor veel belangrijke biologische en chemische processen.
 Hoge concentraties pesticiden blijven het Great Barrier Reef binnendringen
Hoge concentraties pesticiden blijven het Great Barrier Reef binnendringen Hoe, wanneer en waarom industriële ecologie goed is voor het bedrijfsleven
Hoe, wanneer en waarom industriële ecologie goed is voor het bedrijfsleven  Alle ogen gericht op orkaan Michael
Alle ogen gericht op orkaan Michael Wat zit er in de mysterieuze wateren van Tulare Lake? Verontreinigingen, zilverreigers en veel onbekenden
Wat zit er in de mysterieuze wateren van Tulare Lake? Verontreinigingen, zilverreigers en veel onbekenden  Duistere meren overtreffen nu duidelijk, blauwe meren in de VS
Duistere meren overtreffen nu duidelijk, blauwe meren in de VS
Hoofdlijnen
- Hoe transcriptiefactoren clusters van specifieke DNA-sequenties vinden en herkennen
- Wordt de wetenschappelijke methode gebruikt om kennis te verkrijgen?
- Hoe de modulaire structuur van eiwitten ervoor zorgt dat de evolutie vooruitgaat
- Roundworms hebben spierweefsel en een darm met één opening?
- Gezondheidsonderzoekers visualiseren een leven in silico
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Onderzoeken hoe microbiomen onze gezondheid beïnvloeden
- Reviewing over moleculaire geneeskunde onthult de rol van IGF bij kanker en andere proliferatieve ziekten
- Onderzoekers beschrijven hoe cellen het afval buiten zetten om ziekten te voorkomen
- Nieuwe flexibele en taaie superelastische metaallegering is veelbelovend in biomedische toepassingen

- Wetenschappers maken plastic beter afbreekbaar onder UV-licht

- Wetenschappers verbeteren het proces om moeilijk te recyclen plastic afval om te zetten in brandstof

- Chemici leren neurale netwerken om eigenschappen van verbindingen te voorspellen
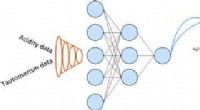
- Een venster voor traploos ladingtransport in organische halfgeleiders
 Stuur deze pagina:Chrome 77 houdt het simpel
Stuur deze pagina:Chrome 77 houdt het simpel Tussen een rots en een harde plek:hoe het leven overleeft onder de gletsjer
Tussen een rots en een harde plek:hoe het leven overleeft onder de gletsjer  Beheersing van ionentransport voor een toekomst van blauwe energie:onderzoek benadrukt het potentieel van nanoporiënmembranen
Beheersing van ionentransport voor een toekomst van blauwe energie:onderzoek benadrukt het potentieel van nanoporiënmembranen  Hebben fosfaat en fosfide hetzelfde oxidatiegetal?
Hebben fosfaat en fosfide hetzelfde oxidatiegetal?  Inzicht in onze onderling verbonden wereld en COVID-19
Inzicht in onze onderling verbonden wereld en COVID-19 Maakt astronomie deel uit van de aardwetenschappen?
Maakt astronomie deel uit van de aardwetenschappen?  Hoe terrorisme onze houding beïnvloedt
Hoe terrorisme onze houding beïnvloedt  Onderzoekers vinden het oudste onbetwiste bewijs van het magnetische veld van de aarde
Onderzoekers vinden het oudste onbetwiste bewijs van het magnetische veld van de aarde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

