
Wetenschap
Waarom is KRF2 niet-polair?
* Moleculaire geometrie: KRF₂ heeft een lineaire moleculaire geometrie. Dit betekent dat de twee fluoratomen aan weerszijden van het Krypton -atoom worden geplaatst.
* Elektronegativiteitsverschil: Fluor is veel elektronegatiefer dan Krypton. Dit betekent dat de fluoratomen de gedeelde elektronen in de KR-F-bindingen dichter bij zichzelf trekken, waardoor gedeeltelijke negatieve ladingen (Δ-) op de fluoratomen en een gedeeltelijke positieve lading (Δ+) op het Krypton-atoom ontstaan.
* Dipoolmoment: Vanwege de ongelijke verdeling van de elektronendichtheid wordt een permanent dipoolmoment gecreëerd. Dit dipoolmoment komt voort uit de vector som van de individuele binddipolen.
Daarom, hoewel KRF₂ een lineaire geometrie heeft, resulteert het significante elektronegativiteitsverschil tussen KR en F -atomen in een polair molecuul.
 Three Gorges Dam:vriend of vijand van broeikasgassen in rivieren?
Three Gorges Dam:vriend of vijand van broeikasgassen in rivieren? Nieuw-Zeelandse bedrijven lopen achter op anderen in hun rapportage over klimaatverandering, en dat is een risico voor hun reputatie
Nieuw-Zeelandse bedrijven lopen achter op anderen in hun rapportage over klimaatverandering, en dat is een risico voor hun reputatie We hebben geen idee hoeveel microplastic er in de bodem van Australië zit (maar het kan veel zijn)
We hebben geen idee hoeveel microplastic er in de bodem van Australië zit (maar het kan veel zijn) Kunstmatige intelligentie om vulkanen te volgen
Kunstmatige intelligentie om vulkanen te volgen NASA ziet tropische storm Pakhar na aanlanding
NASA ziet tropische storm Pakhar na aanlanding
Hoofdlijnen
- Nieuwe analyse van oude vissen kan verklaren hoe de schouder is geëvolueerd
- Wie is Angel Alcala en wat haar bijdrage als bioloog?
- Hoe gebruiken biologen DNA en RNA om organismen te helpen classificeren?
- Hoe is Demeter verwant aan Zeus?
- Hoe worden genen aan- en uitgezet?
- Wat is de taak van Nucleus?
- Binnenkort zullen er krekels naar Las Vegas neerdalen, maar niet degene die je denkt
- Hoe een 'dirigent' betekenis geeft aan chaos in vroege muizenembryo's
- Wat is het vetweefsel dat Symphysis Pubis bestrijkt en kussens wordt genoemd?
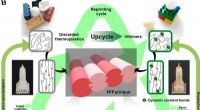
- Upcycling van kunststoffen door dynamische cross-linking
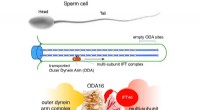
- Transport van moleculaire motoren naar trilhaartjes
- Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen
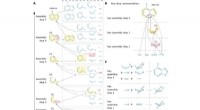
- DNA-schade veroorzaakt door migrerende lichtenergie

- Assemblagetheorie zou goed nieuws kunnen zijn voor de ontdekking van medicijnen
 Nieuw model maakt duidelijk waarom water bevriest bij verschillende temperaturen
Nieuw model maakt duidelijk waarom water bevriest bij verschillende temperaturen  Wat zijn de overeenkomsten en verschillen tussen een prisma en een piramide?
Wat zijn de overeenkomsten en verschillen tussen een prisma en een piramide?  Hoe insecten insecten bestuiven?
Hoe insecten insecten bestuiven?  Geen tijd te verliezen:Moskou drong aan op recyclen, niet branden
Geen tijd te verliezen:Moskou drong aan op recyclen, niet branden Twee decennia van orkanen veranderen kustecosystemen - verhogen algenbloei, vis doodt, dode zones
Twee decennia van orkanen veranderen kustecosystemen - verhogen algenbloei, vis doodt, dode zones Door geen vitale mineralen te winnen, verplaatst Nieuw-Zeeland zijn eigen ecologische voetafdruk – is dat eerlijk?
Door geen vitale mineralen te winnen, verplaatst Nieuw-Zeeland zijn eigen ecologische voetafdruk – is dat eerlijk?  Twee nieuwe uitgestorven primatensoorten zijn gevonden in de Ethiopische site van Gona
Twee nieuwe uitgestorven primatensoorten zijn gevonden in de Ethiopische site van Gona Leren van mosselen:een tweekleppige zeedier inspireert onderzoekers om sterkere polymeren te maken
Leren van mosselen:een tweekleppige zeedier inspireert onderzoekers om sterkere polymeren te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

