
Wetenschap
Hoe kunnen twee coumpounds gemaakt van hetzelfde element zo anders zijn?
1. Verschillende binding:
* ionisch versus covalent: De manier waarop elementen aan elkaar binden, kunnen het gedrag van een verbinding drastisch veranderen. Ionische bindingen omvatten de overdracht van elektronen, waardoor geladen ionen ontstaan die elkaar sterk aantrekken. Covalente bindingen omvatten het delen van elektronen, waarbij moleculen worden gevormd met verschillende sterkte.
* Voorbeeld: Natriumchloride (NaCl) is een ionische verbinding, waardoor een kristalstructuur ontstaat en gemakkelijk oplost in water. Methaan (CH4) is covalent en vormt een gas dat slecht oplosbaar is in water.
2. Moleculaire structuur:
* Vorm is belangrijk: De opstelling van atomen in een molecuul beïnvloedt de eigenschappen aanzienlijk. Zelfs dezelfde elementen kunnen verschillende vormen vormen.
* Voorbeeld: Glucose en fructose hebben beide de formule C6H12O6, maar glucose is een ringvorm en fructose is een ketting, wat leidt tot verschillende zoetheid en reactiviteit.
3. Functionele groepen:
* Complexiteit toevoegen: Specifieke groepen atomen bevestigd aan een molecuul (functionele groepen) kunnen de eigenschappen aanzienlijk veranderen.
* Voorbeeld: Ethanol (C2H5OH) heeft een hydroxylgroep (-oH), waardoor het een vloeistof bij kamertemperatuur is en in staat kan oplossen in water. Ethaan (C2H6) mist deze groep, waardoor het een gas bij kamertemperatuur is en slecht oplosbaar in water.
4. Intermoleculaire krachten:
* aantrekkelijke interacties: De krachten van aantrekkingskracht tussen moleculen (intermoleculaire krachten) beïnvloeden eigenschappen zoals smeltpunt, kookpunt en viscositeit.
* Voorbeeld: Water (H2O) heeft een sterke waterstofbinding, waardoor het een hoog kookpunt heeft. Methaan (CH4) heeft alleen zwakke Van der Waals -krachten, waardoor het een gas bij kamertemperatuur is.
5. Allotropen:
* hetzelfde element, verschillende vorm: Sommige elementen kunnen bestaan in verschillende structurele vormen die allotropen worden genoemd.
* Voorbeeld: Diamant en grafiet zijn beide gemaakt van pure koolstof, maar hun atoomarrangementen geven ze zeer verschillende eigenschappen. Diamond is ongelooflijk hard, terwijl grafiet zacht en glad is.
Conclusie:
De combinatie van binding, moleculaire structuur, functionele groepen, intermoleculaire krachten en allotropie spelen allemaal een cruciale rol bij het bepalen van de eigenschappen van verbindingen, zelfs als ze van dezelfde elementen zijn gemaakt.
 Leven na de dood:hoe insecten uit de dood opstaan en lijken in skeletten veranderen
Leven na de dood:hoe insecten uit de dood opstaan en lijken in skeletten veranderen  Meer dan gegolfde veren:Spotvogels vertonen verhoogde agressie na blootstelling aan lood
Meer dan gegolfde veren:Spotvogels vertonen verhoogde agressie na blootstelling aan lood  Wat is de interactie tussen mens en omgeving in Michigan?
Wat is de interactie tussen mens en omgeving in Michigan?  Hoe Tweet-A-Watt werkt
Hoe Tweet-A-Watt werkt  Waarom een invasieve rups zich een weg baant door boombladeren, tijdens de grootste uitbraakdecennia
Waarom een invasieve rups zich een weg baant door boombladeren, tijdens de grootste uitbraakdecennia
Hoofdlijnen
- Waar worden mesenchymale stamcellen voor gebruikt?
- In welke medicijnen zit schimmel?
- Waarom moeten chromosomen verdubbelen vóór mitose?
- Hoe functioneert de huid als verdediging tegen ziekten? Het spijsverteringsstelsel?
- Do All Cells Have Mitochondria?
- Studie onthult hoe cellen de groei van hun structurele filamenten organiseren
- Osmosis Feiten voor kinderen
- Maakt lachen jou gelukkig?
- Wat zijn de 5Kingdoms die u gebruikt om organismen te classificeren?
- Draagbare chemiekit maakt het mogelijk om de zoetheid van bushfood ter plaatse te testen

- Bio-geïnspireerde materialen—Grafeen-enabled nikkelcomposieten

- Elektronen zetten één stap vooruit zonder twee stappen terug
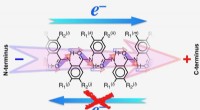
- Surface defect engineering van nanodraadarrays naar efficiënte stikstofreductie voor ammoniaksynthese
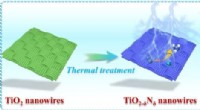
- Chemische verbindingen in voedingsmiddelen kunnen een belangrijk SARS-CoV-2-enzym remmen

 Toevallige ontdekking van een vergeten preprint-experiment uit de jaren 60
Toevallige ontdekking van een vergeten preprint-experiment uit de jaren 60 In de eerste wereld, Nieuw-Zeeland verplicht banken klimaatimpact te rapporteren
In de eerste wereld, Nieuw-Zeeland verplicht banken klimaatimpact te rapporteren Geologen worden vuile vervuilers genoemd, maar waren nodig om klimaatverandering te bestrijden
Geologen worden vuile vervuilers genoemd, maar waren nodig om klimaatverandering te bestrijden Hoe lang is de uranussen lengte van een jaar?
Hoe lang is de uranussen lengte van een jaar?  Hoe weten wetenschappers de structuur van het binnenste van de aarde?
Hoe weten wetenschappers de structuur van het binnenste van de aarde?  Wat gebeurt er met cytokinese in dierlijke cellen?
Wat gebeurt er met cytokinese in dierlijke cellen?  Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst
Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst Jet-aangedreven afvalwaterbehandeling
Jet-aangedreven afvalwaterbehandeling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

