
Wetenschap
Wat is de verandering van het vriespunt van de resulterende oplossing als we 1 mol aluminium chloride ALCL3 in 1000 g water oplossen?
Inzicht in de concepten
* Freezing Point Depression: Het vriespunt van een oplosmiddel wordt verlaagd wanneer er een opgeloste stof in wordt opgelost. Dit is een colligatieve eigenschap, wat betekent dat het afhangt van de concentratie van opgeloste deeltjes, niet op hun identiteit.
* Van't Hoff -factor (i): Deze factor verklaart het aantal ionen waarin een opgeloste stof wordt gedeist wanneer het in een oplosmiddel is opgelost. Aluminiumchloride (alcl₃) dissocieert in vier ionen:één aluminiumion (al³⁺) en drie chloride -ionen (Cl⁻). Dus zijn van't Hoff -factor (i) is 4.
* Vergelijking van het vriespunt depressie: Δt f =i * k f * M
* Δt f is de verandering in het vriespunt
* Ik is de van't hoff -factor
* K f is het vriespuntdepressieconstante van het oplosmiddel (voor water, k f =1,86 ° C/m)
* M is de molaliteit van de oplossing (mol opgeloste stof per kilogram oplosmiddel)
Berekeningen
1. molaliteit (m):
* Je hebt 1 mol alcl₃ opgelost in 1000 g (1 kg) water.
* Daarom molaliteit (m) =1 mol / 1 kg =1 mol / kg
2. Verandering van het vriespunt (Δt f ):
* Δt f =i * k f * M
* Δt f =4 * 1,86 ° C/m * 1 mol/kg
* Δt f =7,44 ° C
Conclusie
Het vriespunt van de oplossing zal afnemen met 7,44 ° C vergeleken met het vriespunt van zuiver water (0 ° C). Dit betekent dat de oplossing zal bevriezen op ongeveer -7,44 ° C.
 Water speelt een cruciale rol in het mechanisme van de Henry-reactie gekatalyseerd door nieuwe kopercomplexen
Water speelt een cruciale rol in het mechanisme van de Henry-reactie gekatalyseerd door nieuwe kopercomplexen Wat is de evenwichtige chemische vergelijking voor verbranding van methylcyclonaan?
Wat is de evenwichtige chemische vergelijking voor verbranding van methylcyclonaan?  Hoe warmteverlies te berekenen tijdens drukontlading in de pijpleiding
Hoe warmteverlies te berekenen tijdens drukontlading in de pijpleiding De puzzel oplossen van polymeren die aan ijs binden voor cryopreservatie
De puzzel oplossen van polymeren die aan ijs binden voor cryopreservatie Waar zijn die elektronen gebleven? Tientallen jaren oud mysterie opgelost
Waar zijn die elektronen gebleven? Tientallen jaren oud mysterie opgelost
Hoofdlijnen
- Is een schimmels groter dan protist?
- Nieuwe studie onthult waarom sommige bedreigde koralen 'algen'-partners ruilen
- Wat zijn de kenmerken van de biosfeer?
- Is gezond voedsel ook automatisch duurzaam?
- Bestaat er een verband tussen intelligentie en psychische aandoeningen?
- Wat beschermt je lichaam?
- Zwarte wolven:de eerste genetisch gemodificeerde roofdieren?
- Wanneer is een genetische drift belangrijke factor van de evolutie?
- Welk water wordt getransporteerd van een wortels naar zijn bladeren in het weefsel?
- Wetenschappers onthullen dubbele levensduur van zonnebloemenzym

- Spinzijde:een kneedbaar eiwit zorgt voor versterking

- Onderzoekers ontsluiten een nieuwe methode voor het testen van op eiwit gebaseerde medicijnen
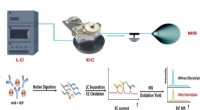
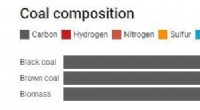
- Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?
- Kleine schubben kunnen dienen als veilig materiaal in implantaten om botten en gewrichten te versterken

 Nieuwe inzichten in evolutie:waarom genen lijken te bewegen
Nieuwe inzichten in evolutie:waarom genen lijken te bewegen  Techbedrijven maken computerchips met menselijke cellen. Is het ethisch?
Techbedrijven maken computerchips met menselijke cellen. Is het ethisch? Uit onderzoek blijkt dat er overeenkomsten zijn tussen de manier waarop duiven het equivalent van woorden leren en de manier waarop kinderen dat doen
Uit onderzoek blijkt dat er overeenkomsten zijn tussen de manier waarop duiven het equivalent van woorden leren en de manier waarop kinderen dat doen  Wat is een isolator van elektriciteit?
Wat is een isolator van elektriciteit?  Wat is een gematigd bos?
Wat is een gematigd bos?  Beroemde gebouwen om te bouwen voor een schoolproject
Beroemde gebouwen om te bouwen voor een schoolproject  Onderzoekers ontdekken structuur van anti-verouderingshormoon
Onderzoekers ontdekken structuur van anti-verouderingshormoon Nieuwe schattingen van Mercurius dun, dichte korst
Nieuwe schattingen van Mercurius dun, dichte korst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

