
Wetenschap
Hoe combineren koolstofatomen bij het vormen van moleculen zoals glucose of vetzuren?
1. Covalente binding:
Koolstof heeft vier elektronen in de buitenste schaal en heeft acht nodig om stabiliteit te bereiken. Om dit te bereiken, deelt Carbon zijn elektronen met andere atomen door covalente obligaties. Dit betekent dat twee atomen een paar elektronen delen en een sterke binding vormen.
2. Kettingen en ringen:
Koolstof kan enkele, dubbele of drievoudige bindingen vormen met andere koolstofatomen, wat leidt tot lange ketens of zelfs cyclische structuren. Dit zorgt voor een enorme diversiteit aan op koolstof gebaseerde moleculen.
3. Deelnemen aan andere elementen:
Koolstof kan binden met verschillende andere elementen, waaronder waterstof, zuurstof, stikstof, fosfor en zwavel. Deze elementen dragen bij aan de unieke eigenschappen van verschillende organische moleculen.
4. Glucose bouwen:
Glucose, een eenvoudige suiker, heeft een moleculaire formule van C 6 H 12 O 6 . Koolstofatomen vormen de zes-koolstofboer van het molecuul. Elk koolstofatoom vormt vier covalente bindingen, verbindend met andere koolstofatomen, waterstofatomen en zuurstofatomen. De opstelling van deze bindingen creëert een ringstructuur, kenmerkend voor suikers.
5. Vetzuren bouwen:
Vetzuren zijn lange ketens van koolstofatomen gekoppeld door enkele bindingen. Elk koolstofatoom wordt gebonden aan waterstofatomen, met uitzondering van de terminale koolstof, die is gebonden aan een carboxylgroep (-cooh). De lengte en verzadiging (aantal dubbele bindingen) van de vetzuurketen beïnvloeden zijn eigenschappen.
Samenvattend:
Het vermogen van koolstof om vier covalente bindingen te vormen, zijn vermogen om zich te verbinden met zichzelf, en zijn affiniteit voor andere elementen stelt het in staat om een divers scala aan moleculen met unieke eigenschappen te vormen. Dit maakt koolstof de basis van het leven, waardoor complexe structuren zoals koolhydraten en vetten mogelijk zijn.
 Ruimtekolonies:hoe kunstmatige fotosynthese de sleutel kan zijn tot duurzaam leven buiten de aarde
Ruimtekolonies:hoe kunstmatige fotosynthese de sleutel kan zijn tot duurzaam leven buiten de aarde  collectief, milieubelanghebbenden zijn net zo slim als wetenschappelijke experts
collectief, milieubelanghebbenden zijn net zo slim als wetenschappelijke experts 'Threat multiplier':hoe klimaatverandering de gezondheid beïnvloedt
'Threat multiplier':hoe klimaatverandering de gezondheid beïnvloedt  Injectiestrategieën zijn cruciaal voor geothermische projecten
Injectiestrategieën zijn cruciaal voor geothermische projecten Leg het verschil uit tussen zelfbestuiving en kruisbestuiving?
Leg het verschil uit tussen zelfbestuiving en kruisbestuiving?
Hoofdlijnen
- Muizensperma overleeft in de ruimte, maar kunnen menselijke baby's dat ook?
- Wat is een vorm van gen die altijd zijn effect heeft als het aanwezig is?
- Hoe warmere wateren als gevolg van klimaatverandering de biochemie en de groei van vissen beïnvloeden
- Wat zijn organismen die zuurstof nodig hebben om te overleven?
- Hoe zijn schimmel en protisten gunstig voor ons?
- Zijn cellen die de meiose verlaten onmiddellijk in staat tot bevruchting?
- Wat is het sterke bewijs van gemeenschappelijke afkomst tussen organisme dat ze deelt?
- Nieuw wiskundig model legt uit hoe gastheren parasietaanvallen overleven
- Wat concludeerde Thomas Hunt Morgan over de chromosomen van de fruitvlieg?
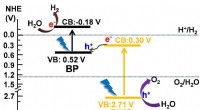
- Ultradunne zwarte fosfor voor door zonne-energie aangedreven waterstofeconomie
- Van oude spijkerbroek naar nieuw T-shirt

- Waterafstotend materiaal werpt af als een slang bij beschadiging

- Chemici banen een nieuwe weg in de zoektocht naar antibiotica

- Machine learning stroomlijnt het zoeken naar efficiëntere chemische reacties drastisch
 United Technologies breekt in 3 onafhankelijke bedrijven in
United Technologies breekt in 3 onafhankelijke bedrijven in Bevat een kern en helpt de beweging door de zeefcel te beheersen?
Bevat een kern en helpt de beweging door de zeefcel te beheersen?  'Is dat een smartwatch die je niet draagt?' Google's kunnen daadwerkelijk verschijnen
'Is dat een smartwatch die je niet draagt?' Google's kunnen daadwerkelijk verschijnen  Groene groengebieden in Toronto creëren structurele en systemische barrières voor geracialiseerde bewoners
Groene groengebieden in Toronto creëren structurele en systemische barrières voor geracialiseerde bewoners Datalek onthult persoonlijke informatie van duizenden LAPD-officieren en sollicitanten
Datalek onthult persoonlijke informatie van duizenden LAPD-officieren en sollicitanten Tech moet worden behandeld als tabak, zegt Facebook-klokkenluider
Tech moet worden behandeld als tabak, zegt Facebook-klokkenluider Hoe maak je Faux Rocks uit kartonnen dozen
Hoe maak je Faux Rocks uit kartonnen dozen NASA selecteert onderzoeken voor eerste missie om de zon te ontmoeten
NASA selecteert onderzoeken voor eerste missie om de zon te ontmoeten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

