
Wetenschap
Waarom heeft calcium niet 10 elektron in zijn 3e schaal?
Hier is een uitsplitsing:
* Atomisch nummer: Calcium heeft een atoomnummer van 20, wat betekent dat het 20 protonen en 20 elektronen heeft.
* Elektronenconfiguratie: De elektronische configuratie van calcium is 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² .
* shell vulling:
* De eerste schaal (n =1) kan maximaal 2 elektronen (1S²) bevatten.
* De tweede schaal (n =2) kan maximaal 8 elektronen bevatten (2S² 2P⁶).
* De derde schaal (n =3) kan maximaal 18 elektronen bevatten, maar deze is niet volledig ingevuld in calcium.
* Waarom niet 10 elektronen in de 3e schaal?
* De 4s subshell (die deel uitmaakt van de 4e schaal) heeft een lagere energie dan de 3D -subshell . Dit komt door het afschermingseffect van binnenste elektronen, waardoor de 4S -subshell stabieler wordt.
* Daarom wordt de 4S -subshell eerst gevuld, waarbij 2 elektronen (4s²) worden vastgehouden voordat elektronen in de 3D -subshell gaan.
Samenvattend: Calcium heeft 8 elektronen in zijn 3e schaal (3S² 3P⁶) omdat de 4S -subschaal eerst wordt gevuld, waardoor de 3D -subshell leeg blijft.
 Hoe veroorzaken menselijke activiteiten verwering van rotsen en grond bij houtkap?
Hoe veroorzaken menselijke activiteiten verwering van rotsen en grond bij houtkap?  Hoe de gevolgen van pollutie verminderen
Hoe de gevolgen van pollutie verminderen IEA zegt dat de wereld laserachtige focus nodig heeft om emissies te verminderen
IEA zegt dat de wereld laserachtige focus nodig heeft om emissies te verminderen Zullen tuinias van zonlicht of schaduw?
Zullen tuinias van zonlicht of schaduw?  De meeste misdaad is in dertig jaar tijd met 90% gedaald – dus waarom denkt het publiek dat deze is toegenomen?
De meeste misdaad is in dertig jaar tijd met 90% gedaald – dus waarom denkt het publiek dat deze is toegenomen?
Hoofdlijnen
- Welke soorten plantencellen zijn er?
- Wat is het belang van een dierencel in het menselijk lichaam?
- Wetenschappers gebruiken geluidsgolven om te testen hoe goed synthetische antilichamen hun antigeendoelen binden
- Het geheim is bekend:de wereld heeft de Owyhees gevonden. Advocaten zeggen dat het tijd is om het land te beschermen
- Make-up en wetenschap Eerlijke ideeën
- Wat doet een bladcel?
- Wat is de dimensie buiten het waargenomen bereik voor menselijke cellen?
- Wat is een potentieel voordeel van genoomsequencing dat kan worden afgewogen tegen mogelijke negatieve effecten?
- Wat zijn schildklierblaasjes?
- Nieuw chemisch proces een eerste stap naar het maken van nucleaire brandstof met vuur

- Onderzoekers ontwikkelen eenvoudige methode om melkproducten in 3D te printen
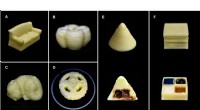
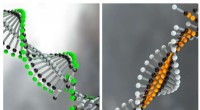
- Wetenschappers creëren nanomaterialen die zich herconfigureren als reactie op biochemische signalen
- Nieuwe goedkope en niet-toxische methode voor het maken van benzeenringen

- Nieuw materiaal van legering van reactorvoering biedt sterkte, weerstand

 Wat is de betekenis achter de richting van de maansikkel?
Wat is de betekenis achter de richting van de maansikkel?  Doorbraak in het begrijpen hoe dodelijke pneumokokken de immuunafweer vermijden
Doorbraak in het begrijpen hoe dodelijke pneumokokken de immuunafweer vermijden  Milieuchemicus knippert met waarschuwingslampje op nieuw nanodeeltje
Milieuchemicus knippert met waarschuwingslampje op nieuw nanodeeltje Nieuwe studie onthult dat een grafeenblad zich gedraagt als een spiegel voor watermoleculen
Nieuwe studie onthult dat een grafeenblad zich gedraagt als een spiegel voor watermoleculen Een savannegang uit de ijstijd laat grote zoogdieren zich over Zuidoost-Azië verspreiden
Een savannegang uit de ijstijd laat grote zoogdieren zich over Zuidoost-Azië verspreiden Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose
Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose Hoe ontdek je een percentage van een getal?
Hoe ontdek je een percentage van een getal?  Algoritme vindt gepersonaliseerde geluidszones in auto's voor bestuurder, passagiers
Algoritme vindt gepersonaliseerde geluidszones in auto's voor bestuurder, passagiers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

