
Wetenschap
Hoeveel subatomaire deeltjes zijn er in goud?
Dit is waarom:
* isotopen: Goud (AU) heeft verschillende isotopen, die atomen van hetzelfde element zijn met hetzelfde aantal protonen maar verschillende aantallen neutronen. De meest voorkomende isotoop is GOLD-197 (¹⁹⁷AU) .
* Subatomaire deeltjes: De drie belangrijkste subatomaire deeltjes zijn protonen, neutronen en elektronen.
* protonen: Bepaal het element (goud heeft 79 protonen).
* neutronen: Variëren tussen isotopen. GOLD -197 heeft 118 neutronen (197 - 79 =118).
* elektronen: Normaal gesproken gelijk aan het aantal protonen, dus goud heeft 79 elektronen.
Daarom, voor de meest voorkomende isotoop, GOLD-197:
* Totale subatomaire deeltjes: 79 (protonen) + 118 (neutronen) + 79 (elektronen) = 276 Subatomaire deeltjes
Vergeet echter niet dat dit alleen voor GOLD-197 is. Andere goudisotopen hebben een ander aantal neutronen en daarom een ander totaal aantal subatomaire deeltjes.
 Wat zit er in deze plant? Het beste geautomatiseerde systeem voor het vinden van potentiële medicijnen
Wat zit er in deze plant? Het beste geautomatiseerde systeem voor het vinden van potentiële medicijnen Veranderingen in de oceaanchemie laten zien hoe het zeeniveau de mondiale koolstofcyclus beïnvloedt
Veranderingen in de oceaanchemie laten zien hoe het zeeniveau de mondiale koolstofcyclus beïnvloedt  Is Hcl een mengselverbinding of -element?
Is Hcl een mengselverbinding of -element?  Wat hebben natriumhydroxide en kalium met elkaar gemeen?
Wat hebben natriumhydroxide en kalium met elkaar gemeen?  Hoeveel elektronenschalen doseren een uraniumatoom?
Hoeveel elektronenschalen doseren een uraniumatoom?
 Botsingsrisico en verlies van leefgebied:studie onderzoekt hoe windturbines in bossen bedreigde vleermuissoorten schaden
Botsingsrisico en verlies van leefgebied:studie onderzoekt hoe windturbines in bossen bedreigde vleermuissoorten schaden  Welk soort weer komt een afgezonderd front met zich mee?
Welk soort weer komt een afgezonderd front met zich mee?  Hoe klimaatverandering en invasieve soorten boomkikkers bedreigen
Hoe klimaatverandering en invasieve soorten boomkikkers bedreigen  COVID-19:Is de toekomst meer plastic?
COVID-19:Is de toekomst meer plastic? Rook van bosbranden heeft verkoelend effect op de watertemperatuur
Rook van bosbranden heeft verkoelend effect op de watertemperatuur
Hoofdlijnen
- Kan lachen ziekten genezen?
- Wetenschappers tonen een moleculaire basis aan voor mieren die fungeren als 'lijfwachten'-planten
- Belangrijkste kenmerk van een microscoop?
- Hoe functie abrupt kan ontstaan of verdwijnen in fysieke en biologische systemen
- Hoe maak je een MRI van je draak:onderzoekers ontwikkelen de eerste hersenatlas van de baardagaam
- Wanneer nakomelingen een mix van de ouders toont, is het ene allel dominant boven het andere?
- Waar zijn de collaseums van gemaakt?
- Designer biosensor kan de productie van antibiotica door microben detecteren
- Wat is één organel die alle prokaryotische en eukaryotische cellen hebben?
- Microfluïdische apparaten verduidelijken hoe dispergeermiddelen asfalteen wijzigen om leidingen open te houden

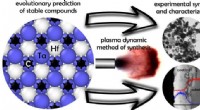
- Voordelige synthese van carbidematerialen met een hoog smeltpunt
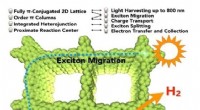
- Fotokatalytische waterstofproductie uit water
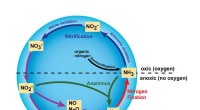
- De fijne kneepjes van de stikstofcyclus onderzoeken
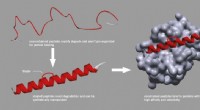
- Nieuwe aanpak om peptidestapeling algemeen beschikbaar te maken
 Organische eutectica met kleine moleculen tonen potentieel voor het vervangen van kunststoffen
Organische eutectica met kleine moleculen tonen potentieel voor het vervangen van kunststoffen  Zou de maanlanding van Apollo 11 vandaag kunnen worden gedupliceerd? 'Veel succes daarmee'
Zou de maanlanding van Apollo 11 vandaag kunnen worden gedupliceerd? 'Veel succes daarmee'  Is Brugge in het noorden of zuiden?
Is Brugge in het noorden of zuiden?  Hoe worden wetenschappelijke gegevens gebruikt als bewijs om theorieën te ontwikkelen, de oorsprong van het universum beschrijven?
Hoe worden wetenschappelijke gegevens gebruikt als bewijs om theorieën te ontwikkelen, de oorsprong van het universum beschrijven?  Uit onderzoek blijkt dat droge lucht de veranderingen in de manier waarop planten drinken en ademen over het hoofd ziet
Uit onderzoek blijkt dat droge lucht de veranderingen in de manier waarop planten drinken en ademen over het hoofd ziet  Bewegen moleculen in ijswater?
Bewegen moleculen in ijswater?  Wat is een kraken van oliefractie?
Wat is een kraken van oliefractie?  (Her)verwerven van het potentieel om alles te worden
(Her)verwerven van het potentieel om alles te worden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

