
Wetenschap
Wat voor soort hybride orbital wordt gebruikt in CO2?
* Structuur: CO2 heeft een lineaire structuur met het koolstofatoom in het midden en twee zuurstofatomen verbonden zich bij 180 graden hoeken.
* Hybridisatie: Om deze lineaire geometrie en de twee dubbele bindingen met zuurstof op te vangen, moet het koolstofatoom twee hybride orbitalen hebben die in tegengestelde richtingen wijzen. Dit wordt bereikt door SP -hybridisatie, waarbij één orbitaal en één p -orbitaal uit de koolstofatoom combineren om twee SP -hybride orbitalen te vormen.
* binding: De twee SP hybride orbitalen op het koolstofatoom vormen sigma -bindingen met de zuurstofatomen. De resterende twee P -orbitalen op het koolstofatoom vormen PI -bindingen met de zuurstofatomen, wat resulteert in de dubbele bindingen.
Het koolstofatoom in CO2 gebruikt dus twee SP -hybride orbitalen om de sigma -bindingen te vormen met de zuurstofatomen, wat resulteert in een lineaire structuur.
 High-fidelity record van de klimaatgeschiedenis van de aarde plaatst huidige veranderingen in context
High-fidelity record van de klimaatgeschiedenis van de aarde plaatst huidige veranderingen in context Welke activiteiten ondernemen mensen meestal in het voorjaar?
Welke activiteiten ondernemen mensen meestal in het voorjaar?  Definitie van goederen en diensten voor economie
Definitie van goederen en diensten voor economie NASA vindt een langwerpige Phanfone nu een tropische storm
NASA vindt een langwerpige Phanfone nu een tropische storm Mexico Stad, uiterst kwetsbaar voor aardbevingsdreigingen
Mexico Stad, uiterst kwetsbaar voor aardbevingsdreigingen
Hoofdlijnen
- Hoe de interactie tussen mens en poema het voedselweb kan veranderen
- Selenium beschermt specifieke interneuronen in de hersenen
- Hoe krijgt een met veroudering geassocieerd enzym toegang tot ons genetisch materiaal?
- Hoe planten wonden genezen:mechanische krachten bepalen de richting van celdeling
- Wat doet monocultuur in gewassen met de bodem?
- Hoe behoudt hexokinase homeostase?
- Het fruitvliegmodel identificeert de belangrijkste toezichthouders achter de orgaanontwikkeling
- Welke van deze gebeurtenissen kan het gevolg zijn van een fout die is gemaakt tijdens de transcriptie?
- Welke spieren bevinden zich in veel interne organen?
- Onderzoekers ontwikkelen elektronenacceptor met gefuseerde ring met 3D-exciton en ladingstransport
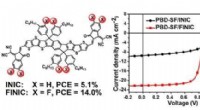
- Scholen moleculaire vissen kunnen beeldschermen verbeteren

- Onderzoekers ontdekken een nieuw bindingsmechanisme tussen kleine en gigantische deeltjes

- Een unieke katalysator maakt de weg vrij voor plastic upcycling
- Computerchemie ondersteunt onderzoek naar nieuwe halfgeleidertechnologieën

 Nieuwe strategie om mechanisch reagerende lichtgevende materialen te ontwerpen
Nieuwe strategie om mechanisch reagerende lichtgevende materialen te ontwerpen Hoe de afstand van een punt naar een lijn te vinden
Hoe de afstand van een punt naar een lijn te vinden  Infanterietank Mark II A-12
Infanterietank Mark II A-12  Wat is de verandering van het vriespunt van de resulterende oplossing als we 1 mol aluminium chloride ALCL3 in 1000 g water oplossen?
Wat is de verandering van het vriespunt van de resulterende oplossing als we 1 mol aluminium chloride ALCL3 in 1000 g water oplossen?  Wat is het dichte metaal in vissenzinkers?
Wat is het dichte metaal in vissenzinkers?  Noem het petroleumproduct dat wordt gebruikt voor het opduiken van wegen?
Noem het petroleumproduct dat wordt gebruikt voor het opduiken van wegen?  Poreuze kristallen gebruiken om licht te oogsten
Poreuze kristallen gebruiken om licht te oogsten Hoe de bindingsvolgorde te berekenen
Hoe de bindingsvolgorde te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

