
Wetenschap
Verliest kalium elektronen om kationen te vormen?
Ja, kalium (k) verliest elektronen om kationen te vormen.
Dit is waarom:
* Elektronische configuratie: Kalium heeft één valentie -elektron in zijn buitenste schaal.
* stabiliteit: Atomen zijn het meest stabiel wanneer ze een volledige buitenste schaal van elektronen hebben.
* ionisatie: Om een stabiele configuratie te bereiken, verliest kalium gemakkelijk zijn enkele valentie -elektron en wordt hij een positief geladen ion (kation). Dit kation wordt weergegeven als K⁺.
Samenvattend: Kalium verliest één elektron om een positief geladen ion (k⁺) te worden om een stabiele elektronenconfiguratie te bereiken.
Hoofdlijnen
- Onderzoekers ontdekken hoe cellen virustoxine herkennen
- Wat is de basis voor uitzonderingen op het Aufbau-principe?
- Gedurende welk deel van de interfase worden de centromeren gerepliceerd?
- Wat draagt berichten naar je spieren en klieren?
- Drie voorbeelden van een enkelvoudig allel-kenmerk
- Wat zou er gebeuren als de cel geen DNA had?
- Waar en hoe een eatherquake optreedt?
- Welke van de volgende technologieën opende een nieuwe takwetenschap in de jaren 1970 A. Lichtmicroscoop B. Veranderende genen Bacteriën C. Centrifuge D. Chromatografie?
- Wat is de definitie van diafragma in samengestelde microscoop?
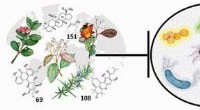
- Herziening van de rol van planten in antibacteriële activiteit maakt nieuwe paden vrij voor het ontdekken van geneesmiddelen
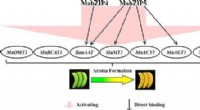
- Aantrekkelijke bevinding suggereert waarom koeling bananenaroma's dempt
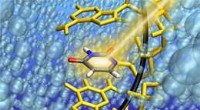
- RNA-streng maakt het vangen van uracil in de kritieke toestand mogelijk
- Harde magneten met één molecuul:tetranucleaire zeldzame aardmetaalcomplexen met gigantische spin

- Metalen organische kaders metalen meesterschap

 De kleinste vulpen ter wereld?
De kleinste vulpen ter wereld?  Hoe transformeren kleine boeren in Noord-China naar duurzame productie?
Hoe transformeren kleine boeren in Noord-China naar duurzame productie? De omvang van getuige zijn van geweld in gevangenissen beoordelen
De omvang van getuige zijn van geweld in gevangenissen beoordelen Hebben we piekolie bereikt?
Hebben we piekolie bereikt?  In het laboratorium gekweekte zuivel:de volgende voedselgrens
In het laboratorium gekweekte zuivel:de volgende voedselgrens Studie onthult enorme diversiteit aan oceaanmicroben
Studie onthult enorme diversiteit aan oceaanmicroben 40 ton visnetten teruggevonden bij opruiming Stille Oceaan
40 ton visnetten teruggevonden bij opruiming Stille Oceaan Welke grondsoort komt op veel boerderijen voor?
Welke grondsoort komt op veel boerderijen voor?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


